ЗАПИСЬ НА ПРИЁМ 8(495)304-30-40 ТЕЛЕФОН ДЛЯ СПРАВОК 8(495)304-30-39 РАСПИСАНИЕ ВРЕМЕНИ ПРИЕМА
ЧТО ВАЖНО ЗНАТЬ О КОЛОРЕКТАЛЬНОМ РАКЕ (КРР)?
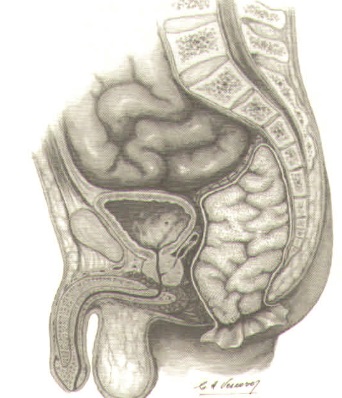
Рак толстой кишки – одно из наиболее распространенных онкологических заболеваний в Мире.
Несвоевременная диагностика и позднее обращение в специализированные медицинские учреждения приводит к тому, что у 30% пациентов диагностируют IV стадию заболевания – устанавливают наличие отдаленных метастазов.
Основным фактором, определяющим прогноз при онкологической патологии и, в частности при КРР, является ранняя диагностика.
Общая пятилетняя выживаемость у больных при I стадии заболевания - >80%; при II – 75-80%; при III – 75-30%; при IV – не превышает 5%.
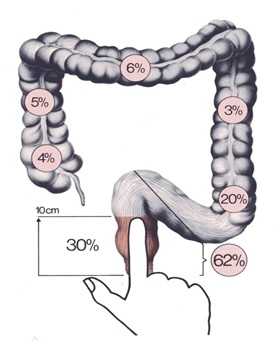
Частота поражения злокачественными новообразованиями различных отделов толстой кишки
СКРИНИНГ
К скринингу относят методы исследования, позволяющие диагностировать опухоль толстой кишки на ранней стадии, до возникновения симптомов заболевания.
По данным Национального института здоровья (NIH) использование диагностических методов обследования (скрининга), позволяет в 90% случаев предупредить развитие КРР.
Скрининг в общей возрастной популяции
Скрининговые мероприятия по колоректальному раку для лиц старше 50 лет с неотягощенным семейным анамнезом включают:
– 1 раз в год – тест на скрытую кровь (гемоккульт-тест)
– 1 раз в 5 лет – сигмоидоскопию
– 1 раз в 10 лет – колоноскопию.
Альтернативой эндоскопическому методу исследования является ирригоскопия или виртуальная КТ-колонография.
Скрининг в группе риска
Факторами риска для КРР являются:
– наличие в анамнезе полипов толстой кишки
– рак ободочной кишки у родственников первой степени родства моложе 60 лет
– воспалительные заболевания кишечника (язвенный колит, болезнь Крона и др.)
При выявлении полипов толстой кишки выполнение диагностической колоноскопии необходимо проводить чаще чем 1 раз в 10 лет, в зависимости от факторов эндоскопического риска развития колоректального рака:
– низкий риск (тубулярные аденомы в количестве 1-2 и/или размерами менее 1 см) – колоноскопия каждые 5 лет
– средний риск (тубулярные аденомы в количестве 3-10 и/или размерами более 1 см, высокая степень дисплазии, виллезный полип) – колоноскопия каждые 3 года
– высокий риск (неполная полипэктомия, более 10 полипов) – индивидуальная программа обследования.
2. Для лиц с наличием рака ободочной кишки у родственников первой степени родства моложе 60 лет рекомендуется начинать скрининг в возрасте 40 лет или, как минимум, за 10 лет до достижения возраста, в котором родственникам поставили диагноз.
3. Воспалительные заболевания кишечника (неспецифический язвенный колит, болезнь Крона) – эндоскопическая колоноскопия в любом возрасте после начала клинических проявлений каждые 1-2 года, часть из которых сопровождается множественными (каждые 10 см) биопсиями слизистой с получением не менее 30 фрагментов тканей для гистологической оценки.
NB! В группе больных с наличием клинических симптомов (боль в животе, вздутие живота, нарушение стула, патологические примеси в стуле), а также с «малыми онкологическими симптомами» (слабость, недомогание, анемия) в комплексную программу обследования необходимо включать эндоскопическую колоноскопию
СТАНДАРТЫ ОБСЛЕДОВАНИЯ ПАЦИЕНТА С ОПУХОЛЬЮ ТОЛСТОЙ КИШКИ
Обязательные исследования:
– эндоскопическая колоноскопия с биопсией
– морфологическое исследование биопсийного материала
– эндоскопическая гастродуоденоскопия
– мультиспиральная компьютерная томография (МСКТ) грудной клетки, брюшной полости, малого таза, магнитно-резонансная томография (МРТ) малого таза (для опухолей прямой кишки)
– рентгенография грудной клетки
– ультразвуковое исследование органов брюшной полости
– онкологические маркеры крови: РЭА, СА - 19.9; СА - 125 (для женщин)
Дополнительные исследования:
– ирригоскопия
– ПЭТ (ПЭТ-КТ)
– радиоизотопное исследование костей
– МРТ головного мозга или КТ с контрастированием (при наличии клинических симптомов метастатического поражения головного мозга).
NB!
Семейный аденоматозный полипоз - является аутосомно-доминантным заболеванием, развивающимся в результате АРС мутаций* ответственен за развитие 1% и менее всех форм КРР.
MUTYH-ассоциированный полипоз - представляет собой аутосомно-рецессивное заболевание, развивающееся в результате биаллельной мутации в MUTYH гене. Клиническая диагностика основывается на обнаружении более 100 колоректальных аденом. Необходима консультация генетика, исследование крови на наличие мутаций в гене АРС, MUTYH
Синдром Линча
Синдром Линча относится к заболеваниям, наследуемым по аутосомнодоминантному типу, представляя собой 3% всего КРР. Причиной его возникновения является мутация одного из генов, ответственных за ошибки репарации ДНК (mismatch repair — MMR): MLH1, MSH2, MSH6 или PMS2.
Критерии синдрома Линча (табл. № 1).

Необходима консультация генетика, исследование крови на наличие мутаций в гене MLH1, MSH2, MSH6, PMS2, MSI
Семейный колоректальный рак
Колоректальный рак, встречающийся у родственников, без доказательств в пользу наследственных синдромов. Риск развития колоректального рака увеличивается в 2-3 раза для субъектов, имеющих одного заболевшего колоректальным раком родственника первой линии родства, если на момент постановки диагноза возраст родственника превышал 50 лет. Для субъектов с двумя и более родственниками первой линии родства, заболевшими колорекатльным раком в любом возрасте, или с одним родственником первой линии родства, заболевшим в возрасте до 50 лет, риск развития колоректального рака увеличивается в 4-6 раз.
Рекомендуется выполнение скрининговой колоноскопии родственникам с последующим регулярным наблюдением онкологом, колопроктологом
ЭНДОСКОПИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
видеоколоноскопия является золотым стандартом в диагностике КРР. В ряде случаев (при наличии доброкачественных новообразований в толстой кишке) диагностическая колоноскопия может быть расширена до лечебной процедуры с удалением данных новообразования.
Для описания эндоскопических находок в толстой кишке используется классификация и терминология, предложенная Японским обществом изучения колоректального рака.
При описании опухоли толстой кишки врач указывает: локализацию, размер, часть окружности кишки занимаемую опухолью, макроскопический тип и глубину инвазии (для раннего рака).
Локализация опухоли
Отделы толстой кишки:
– С: слепая кишка
– V: устье аппендикулярного отростка
– А: восходящая ободочная кишка
– Т: поперечная ободочная кишка
– D: нисходящая ободочная кишка
– S: сигмовидная ободочная кишка
– RS: ректосигмоидный отдел толстой кишки
– R: прямая кишка
Макроскопические типы опухоли
– Тип 0: поверхностный тип
– Тип 1: полиповидный тип
– Тип 2: язвенный тип с четкими границами опухоли
– Тип 3: язвенный тип без четких границ опухоли
– Тип 4: диффузно-инфильтративный тип
– Тип 5: неклассифицируемый тип.
– Тип 0 - применяется к раннему раку, когда установлено, что опухоль распространяется только в слизистом и подслизистом слоях стенки толстой кишки.
Выделяют следующие подтипы опухоли толстой кишки:
– Ip – имеющий ножку
– Isp – на узком основании
– Is – cидячий
– IIa – поверхностно-приподнятый (менее 10 мм в диаметре)
– IIb – плоский
– IIс – углубленный.
Если опухоль состоит из двух различных подтипов, то в описании на первом месте указывается тот подтип, который занимает большую массу опухоли, а затем через «+» указывается другой подтип, например, IIa+IIс.
В отдельную группу из подтипа IIa выделяют латерально распространяющиеся опухоли (LST) – поверхностно-приподнятые по форме, диаметром более 10 мм. Выделяют следующие формы LST:
1. Зернистые (гранулярные) – LST-G:
– гомогенные (наименее злокачественные даже при диаметре более 5 см)
– смешанной зернистости (имеются гранулы более 1 см в диаметре).
2. Незернистые (негранулярные) – LST-NG:
– псевдоуглубленные (наиболее опасные – риск малигнизации уже при диаметре углубления от 2 мм)
– плоско-поверхностные.
Для распознавания макроскопических форм рака применяются дополнительные методики улучшения визуализации: хромоскопия, осмотр в узком спектре света (NBI), эндоскопия с увеличением, аутофлюоресцентная эндоскопия. Это помогает определить биологическую природу этих поражений и предсказать ход их дальнейшего развития.
Хромоколоноскопия
Это метод окрашивания слизистой оболочки толстой кишки с помощью разнообразных растворов красителей, одни из которых избирательно поглощаются клетками слизистой или новообразованиями (адсорбирующиеся), другие подчеркивают рельеф, накапливаясь в естественных углублениях слизистой (неадсорбирующиеся).
Узкоспектральная эндоскопия (Narrow band imaging)
Метод оптической диагностики (NBI) основан на использовании специальных фильтров, суживающих спектр световой волны. Cветовые фильтры позволяют получить детальное изображение сосудистого рисунка тканей, его изменений воспалительного или опухолевого генеза. Кроме этого, применение NBI повышает контрастность изображения, что создает эффект виртуальной хромоскопии.
Хромоколоноскопия и узкоспектральная эндоскопия позволяют точно установить диагноз злокачественного новообразования на самых ранних стадиях.
Лечебная колоноскопия
Для удаления слизистых образований толстой кишки в современой медицине используются следующие методы: полипэктомия, резекция слизистой (EMR), диссекция подслизистого слоя (ESD).
Полипэктомия.
Наличие доброкачественных полипов, имеющих ножку, без распространения за пределы основания ножки является показанием для полипэктомии.
Эндоскопическая резекция слизистой (EMR).
В отличие от полипэктомии сопровождается гидравлической препаровкой тканей. Под слизистую оболочку с помощью инъектора вводится раствор, приподнимающий и отделяющий ее от подслизистого слоя. Затем патологический очаг отсекается диатермической петлей. Манипуляция может дополняться установлением меток по границам патологического очага и/или проведением циркулярного разреза для облегчения накладывания петли.
Показания к EMR:
– Плоские доброкачественные образования различного диаметра.
Эндоскопическая диссекция подслизистого слоя (ESD).
Эта методика позволяет контролируемо и надежно удалить обширные очаги поражения одним блоком. После выставления меток по границам образования и выполнения циркулярного разреза патологический очаг удаляется путем диссекции подслизистого слоя.
Показания к ESD:
– ранний рак - Рак Tis - Рак in situ интраэпителиальный или инвазия собственной пластинки без инвазии в подслизистый слой
– латерально растущие опухоли гладкого типа
– латерально растущие опухоли гранулярного типа с крупными узлами
– большие доброкачественные аденомы толстой кишки.
Эндоскопические вмешательства при толстокишечной непроходимости
Для декомпрессии толстой кишки при стенозирующих образованиях применяются следующие методики:
– установка зондов для декомпрессии за зону стеноза
– установка непокрытых стентов.
Не рекомендуется использовать такие методики, как:
– бужирование (высокий риск разрыва стенки кишки в области образования)
– баллонная дилатация (высокий риск разрыва стенки кишки в области образования)
– электрокоагуляция (высокий риск перфорации)
– установка покрытых стентов (высокий риск миграции стента в раннем послеоперационном периоде).
Эндоскопические методы декомпрессии могут использоваться как окончательный вариант паллиативного лечения в случае неоперабельности образования либо как временная помощь для подготовки к радикальному оперативному лечению.
Для лечения стриктур анастомозов используются:
– бужирование
– баллонная дилатация.
Как промежуточный метод в ряде случаев может применяться заведение зондов проксимальнее зоны стеноза для декомпрессии толстой кишки.
Толстокишечное кровотечение
При кровотечении из образования толстой кишки могут быть применены следующие эндоскопические методики:
– инъекция растворов
– электрокоагуляция сосуда
– клипирование сосуда
– аргоноплазменная коагуляция.
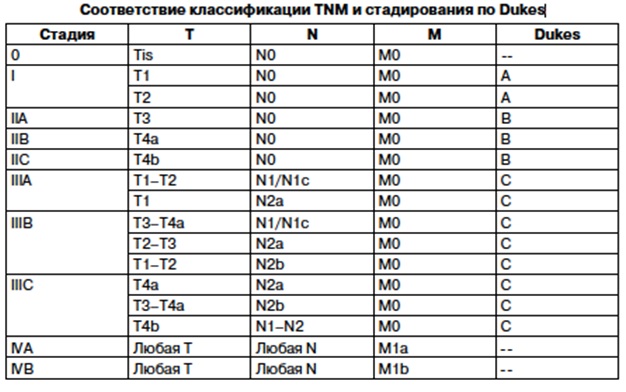
СТАДИРОВАНИЕ РАКА ОБОДОЧНОЙ КИШКИ
У всех больных КРР стадия заболевания определяется по системе TNM, разработанной AJCC. Для интегральной оценки также используются классификации по стадиям (I-IV) и по Dukes.
СТАДИРОВАНИЕ ПО TNM (издание 7-ое, 2009г.)
Первичная опухоль (Т)
|
TX |
Первичная опухоль не может быть оценена |
|
T0 |
Нет первичной опухоли |
|
Tis |
Рак in situ интраэпителиальный или инвазия собственной пластинки |
|
T1 |
Опухоль прорастает слизистую оболочку и подслизистый слой |
|
T2 |
Опухоль прорастает мышечный слой |
|
T3 |
Опухоль прорастает субсерозный слой
|
|
T4a |
Опухоль пенетрирует поверхность висцеральной брюшины |
|
T4b |
Опухоль врастает в соседние органы и структуры |
Регионарные лимфатические узлы (N)
|
NX |
Регионарные лимфоузлы не могут быть оценены |
|
N0 |
Поражения регионарных лимфоузлов нет |
|
N1 |
Метастазы в 1-3 регионарных лимфоузла |
|
N1a |
Метастазы в 1 регионарный лимфоузел |
|
N1b |
Метастазы в 2-3 регионарных лимфоузла |
|
N1c |
Депозиты опухоли, располагающиеся субсерозно, в брыжейке, периколи- ческих тканях при отсутствии метастатических регионарных лимфоузлов * |
|
N2 |
Метастазы в 4 и более регионарных лимфоузла |
|
N2a |
Метастазы в 4-6 регионарных лимфоузлов |
|
N2b |
Метастазы в 7 и более регионарных лимфоузло |
* Опухолевые отсевы в субсерозном слое или неперитонизированных участках параколитической или параректальной клетчатки без формирования метастатических лимфатических узлов. Если патоморфолог считает, что ткань лимфоузла полностью замещена опухолью (обычно такие образования имеют ровные края), то такое поражение необходимо классифицировать именно как поражение лимфоузлов, т.е. N1a, N1b, N2a, или N2b.
Отдаленные метастазы (M)
|
M0 |
Отдаленных метастазов нет |
|
M1 |
Отдаленные метастазы |
|
M1a |
Метастазы ограничены 1 органом |
|
M1b |
Метастазы в более чем 1 орган или париетальную брюшину |
Глубина опухолевой инвазии:
M – инвазия слизистого слоя
SM – опухоль прорастает подслизистый слой
MP – опухоль прорастает мышечный слой
SS – опухоль прорастает субсерозный слой
SE – опухоль прорастает висцеральную брюшину
SI – опухоль врастает в соседние органы и структуры.
Оценку TNM-стадии следует проводить на различных этапах первичного лечения и обследования. При этом выделяют:
• c-clinical – стадирование на основании клинических данных (осмотр, диагностические исследования, гистология и цитология)
• s-surgucal – стадирование на основании интраоперационных данных (осмотр, диагностические исследования, срочная гистология и цитология)
• p-pathological – стадирование на основании патоморфологических данных (препараты, полученные в результате оперативных вмешательств)
• f-final – заключительное стадирование – сопоставление всех вышеописанных данных с преимущественным значением результатов патоморфологических исследований.
Множественная локализация новообразований
Мультицентрический колоректальный рак – наличие более двух новообразований толстой кишки.
Первично множественный рак – наличие первичной опухоли в разных органах.
Синхронный рак – выявление двух и более первичных опухолей в интервале 1 год.
Метахронный рак – выявление двух и более первичных опухолей в интервале более 1 года.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Является одним из основных методов лечения КРР, позволяющим вылечить пациента на ранних стадиях заболевания и значительно продлить его жизнь при запущенных - IV стадии КРР.
Основные виды операций на ободочной кишке
Резекция ободочной кишки – удаление ее части. В зависимости от размеров и локализации удаленной части кишки выделяют сегментарные резекции – удаление части анатомического отдела ободочной кишки (например, резекция сигмовидной кишки, резекция правого или левого изгиба ободочной кишки).
Гемиколэктомия – удаление половины ободочной кишки; от терминального отдела подвздошной кишки до середины поперечной ободочной – правосторонняя, от середины поперечной ободочной кишки до ректосигмоидного отдела (прямой кишки) – левосторонняя.
Расширенная гемиколэктомия – как наиболее частый вариант расширения объема – удаление более половины ободочной кишки, при котором граница резекции переходит на противоположную сторону и сопровождается перевязкой средней ободочной артерии у ее основания.
Субтотальная резекция ободочной кишки – удаление 3/4 ободочной кишки с оставлением при этом проксимальной либо дистальной четверти (при условном делении ободочной кишки на четыре больших отдела: восходящий, поперечный, нисходящий, сигмовидный).
Колэктомия – удаление всей ободочной кишки. Под этим термином в настоящее время подразумевается не только указанный объем резекции толстой кишки, но и (второй вариант) удаление ободочной и слепой кишки. Таким образом, колэктомия может быть закончена формированием как цеко-, так и илеоректального анастомоза.
Стандарты лимфодиссекции
Группы регионарных лимфоузлов ободочной кишки:
– надободочные лимфоузлы (эпиколические), непосредственно прилежащие к стенке кишки, и околоободочные (параколические) – вдоль маргинальных сосудов (лимфоузлы первого уровня)
– мезоколические лимфоузлы – расположены вдоль основных лимфоваскулярных ножек до дуги Риолана (лимфоузлы второго уровня)
– апикальные лимфоузлы – расположены у основания магистральных висцеральных артерий (лимфоузлы третьего уровня).
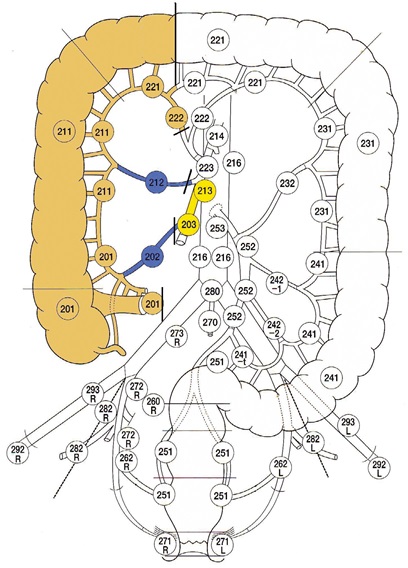
Японская классификация лимфоузлов по локализации
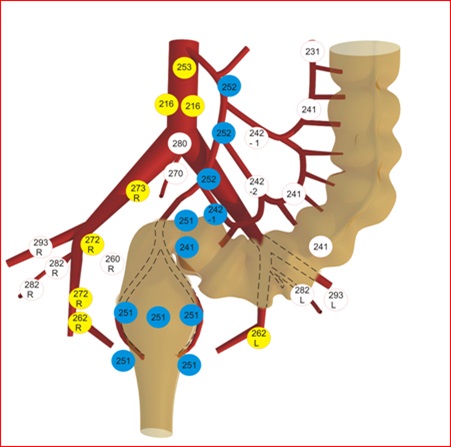
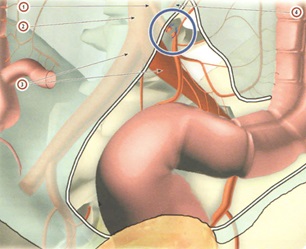
В соответствии с японской классификацией все лимфатические узлы пронумерованы трехзначными цифрами (рис.1).
Первая цифра – отдел (2 – брюшная полость, малый таз). Вторая цифра – анатомическая область, соответствующая лимфоваскулярной ножке (подвздошно-ободочная артерия – 0, правая ободочная артерия –1, средняяободочная артерия – 2, левая ободочная – 3 и т.д. по часовой стрелке). Третья цифра – степень удаленности от кишки: 1 – эпиколические и параколические лимфоузлы, 2 – мезоколические (интермедиальные) лимфоузлы, 3 – апикальные, или главные лимфоузлы. Причем 1, 2 и 3 группы лимфоузлов соответствуют уровням лимфодиссекции D1, D2, D3.
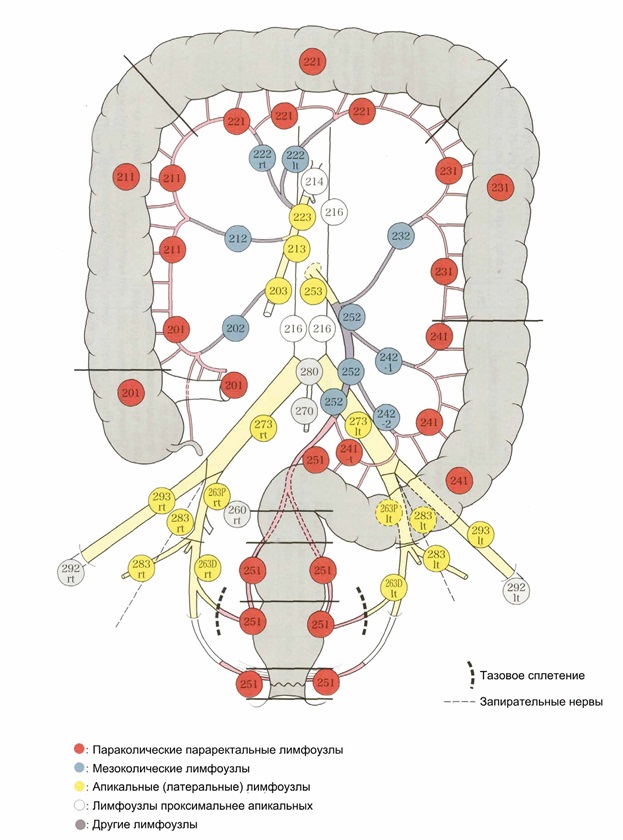
Рис. 1. Классификация и нумерация лимфоузлов толстой кишки
Объемы лимфодиссекции
В соответствии с уровнем удаляемых лимфатических узлов выделяют следующие объемы лимфодиссекции:
– D1 – удаление эпиколических и параколических лимфоузлов
– D2 – D1 и удаление мезоколических лимфоузлов
– D3 – D2 и удаление апикальных лимфоузлов.
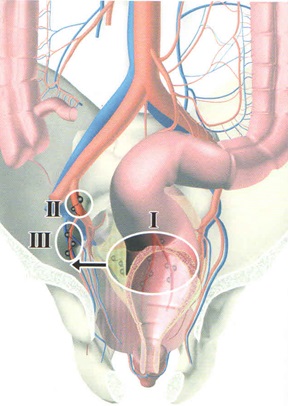
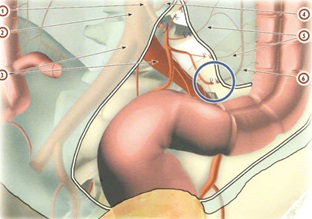
Предоперационное и интраоперационное TNM-стадирование позволяет осуществить дифференцированный подход к выбору объема лимфодиссекции (рис.2 ).

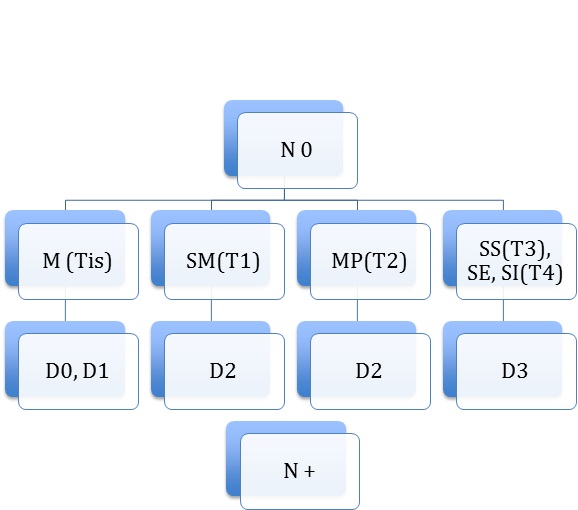
Рис. 2. Дифференцированный подход к выбору объема лимфодиссекции
В определенных клинических ситуациях (Тis, паллиативные резекции у больных высокого риска) допустимо выполнение лимфодиссекции в объеме D1. Лимфодиссекция в объеме D3 не имеет лечебных преимуществ перед лимфодиссекцией D2, однако расширение объема лимфодиссекции (D3) позволяет более точно осуществить стадирование, что оправдано для разграничения II и III стадий заболевания (Dukes В или Dukes С).
Таким образом, расширение объема лимфодиссекции (до D3) оправдано при стадировании сТ3-Т4, клинических данных о возможном поражении регионарных лимфатических узлов (сN1-2), а также у пациентов молодого возраста. Следует выполнять объем лимфодиссекции, обеспечивающий возможность выделения не менее 12 лимфоузлов для определения стадии N по классификации ТNM. Лимфоузлы следует удалять единым блоком с основными сосудами, кровоснаб жающими вовлеченный сегмент кишки, либо выполнять отдельную лимфодиссекцию путем «скелетизации» сосудов.
Минимальная протяженность лимфодиссекции
При определении минимальной протяженности лимфодиссекции эпиколических и параколических лимфоузлов (что соответствует минимальному отступу вдоль кишки от края опухоли) следует руководствоваться следующими принципами:
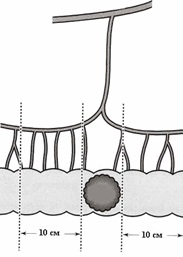
Рис. 3
- опухоль в проекции лимфоваскулярной ножки – обе – дистальная и проксимальная линии лимфодиссекции на расстоянии не менее 10 см от края опухоли (рис.3).
В случае если на расстоянии до 10 см от края опухоли проецируется продолжение одной или двух (с обеих сторон) лимфоваскулярных ножек, необходимо дополнительно отступить от последних еще 5 см.
Таким образом, оказываются возможными еще три варианта отступов:
– опухоль между двух лимфоваскулярных ножек, которые ближе, чем 10 см от края опухоли, – необходимо и дистально и проксимально отступить еще на 5 см от проекции соответствующей лимфоваскулярной ножки (рис.4).
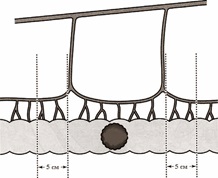
Рис. 4
– опухоль дистальнее проекции ближайшей лимфоваскулярной ножки – дистальная линия лимфодиссекции параколических лимфоузлов не менее 10 см от края опухоли, проксимальная – 5 см проксимальнее проекции ближайшей лимфоваскулярной ножки, но не менее 10 см от края опухоли (рис. 5)7
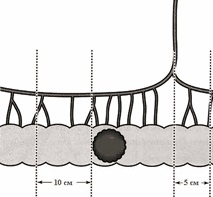 Рис. 5
Рис. 5
И наоборот:
– опухоль проксимальнее проекции ближайшей лимфоваскулярной ножки – проксимальная линия лимфодиссекции параколических лимфоузлов не менее 10 см от края опухоли, дистальная – 5 см дистальнее проекции ближайшей лимфоваскулярной ножки, но не менее 10 см от края опухоли.
Отмеченные пр
D2 – 201, 211 и часть 221 группы (эпиколические и параколические), 202, 212 группы (лимфоузлы подвздошно-ободочной и правой ободочной артерий), 222-rt группа (лимфоузлы правой ветви средней ободочной артерии).
D3 – дополнительно к D2 осуществляется лимфодиссекция 203 группы (лимфоузлы у основания подвздошно-ободочной артерии) и 213 группы (лимфоузлы у основания правой ободочной артерии).
Проксимальная граница резекции – подвздошная кишка в 10-15 см от илеоцекального угла.
Дистальная граница резекции – проксимальная или средняя треть поперечной ободочной кишки.
Анастомоз: илеотрансверзоанастомоз.
авила могут быть использованы для определения границ резекции ободочной кишки при ее сегментарных резекциях.
В остальных случаях стандартным считается отступление на 10 см от края опухоли.
Границы резекции кишки
При выборе границ резекции кишки следует учитывать необходимость сохранения адекватного кровоснабжения и выполнения адекватного объема лимфодиссекции.
Виды операций
Правосторонняя гемиколэктомия.
Локализация опухоли: слепая, восходящая ободочная кишка.
Лигируемые сосуды:
– подвздошно-ободочные
– правые ободочные
– правые ветви средних ободочных сосудов.
Объем лимфодиссекции:
Рис.6. Правосторонняя гемиколэктомия
Расширенная правосторонняя гемиколэктомия.
Локализация опухоли: правый изгиб, поперечная ободочная кишка
проксимальнее проекции средних ободочных сосудов. При локализации опухоли в слепой и восходящей ободочной кишке, если имеются клинические признаки поражения лимфатических узлов в бассейне средней ободочной артерии.
Лигируемые сосуды:
– подвздошно-ободочные
– правые ободочные
– средние ободочные.
Объем лимфодиссекции:
D2 – 201, 211, 221 группы (эпиколические и параколические), 202, 212, 222 группы (лимфоузлы подвздошно-ободочной, правой ободочной и средней ободочной артерий).
D3 – дополнительно к D2 – 203 группа (лимфоузлы у основания подвздошно-ободочной артерии), 213 группа (лимфоузлы у основания правой ободочной артерии), 223 группа (лимфоузлы у основания средней ободочной артерии). Проксимальная граница резекции – подвздошная кишка в 10-15 см от илеоцекального угла.
Дистальная граница резекции – дистальная треть поперечной ободочной кишки.
Анастомоз: илеотрансверзоанастомоз.
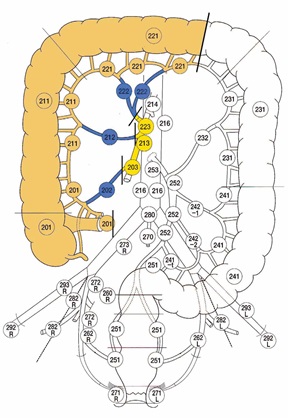
Рис.7. Расширенная правосторонняя гемиколэктомия
Левосторонняя гемиколэктомия.
Термин левосторонняя гемиколэктомия устойчиво используется в литературе
для обозначения операции как с удалением сигмовидной кишки (трансверзоректоанастомоз), так и с сохранением сигмовидной кишки (трансверзосигмоанастомоз). В последнем случае нижняя брыжеечная артерия сохраняется, а из данного бассейна лигируются лишь левые ободочные сосуды. При наличии длинной сигмовидной кишки обозначить подобную операцию как «удаление левой половины ободочной кишки» не вполне корректно. Поэтому данный вариант операции уместнее называть резекцией левых отделов ободочной кишки
Возможная локализация опухоли: нисходящая ободочная кишка, проксимальная и средняя треть сигмовидной кишки.
Лигируемые сосуды:
– нижние брыжеечные.
Объем лимфодиссекции:
D2 – 231 и 241 группы (эпиколические и параколические), 232 группа (лимфоузлы левой ободочной артерии), 242 группа (лимфоузлы сигмовидных артерий), 252 группа (лимфоузлы нижней брыжеечной артерии).
D3 – дополнительно 253 группа (лимфоузлы у основания нижней брыжеечной артерии проксимальнее места отхождения левой ободочной артерии).
Проксимальная граница резекции – поперечная ободочная кишка.
Дистальная граница резекции – ректосигмоидный отдел.
Анастомоз: трансверзоректоанастомоз.
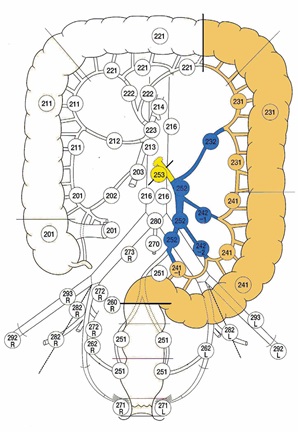
Рис.8. Левосторонняя гемиколэктомия
Расширенная левосторонняя гемиколэктомия.
Возможная локализация опухоли: поперечная ободочная кишка дистальнее проекции средних ободочных сосудов, левый изгиб ободочной кишки.
Лигируемые сосуды:
– средние ободочные
– нижние брыжеечные.
Объем лимфодиссекции:
D2 – 221, 231 и 241 группы (эпиколические и параколические), 222 группа (лимфоузлы средней ободочной артерии), 232 группа (лимфоузлы левой ободочной артерии), 242 группа (лимфоузлы сигмовидных артерий) и 252 группа (лимфоузлы нижней брыжеечной артерии).
D3 – дополнительно 223 группа (лимфоузлы у основания средней ободочной артерии), 253 группа (лимфоузлы у основания нижней брыжеечной артерии проксимальнее места отхождения левой ободочной артерии).
Проксимальная граница резекции – поперечная ободочная кишка.
Дистальная граница резекции – ректосигмоидный отдел.
Анастомоз: трансверзоректоанастомоз.
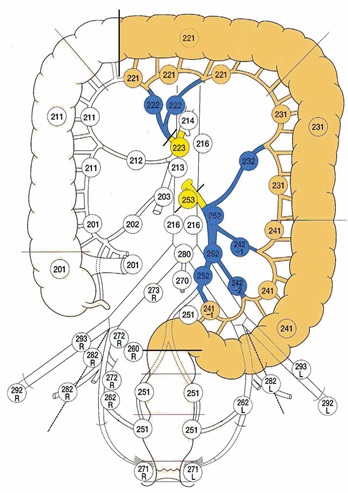
Рис.9. Расширенная левосторонняя гемиколэктомия
Субтотальная колэктомия.
Возможная локализация опухоли: поперечная ободочная кишка, множественные опухоли ободочной кишки.
Лигируемые сосуды:
– правые ободочные
– средние ободочные
– левые ободочные.
Объем лимфодиссекции:
D2 – 211, 221, 231, 241 группы (эпиколические и параколические), 212 группа (лимфоузлы правой ободочной артерии), 222 группа (лимфоузлы средней ободочной артерии), 232 группа (лимфоузлы левой ободочной артерии) и 242 группа (лимфоузлы сигмовидных артерий).
D3 – дополнительно 213 группа (лимфоузлы у основания правой ободочной артерии), 223 группа (лимфоузлы у основания средней ободочной артерии).
Проксимальная граница резекции - слепая кишка.
Дистальная граница резекции - сигмовидная кишка.
Анастомоз - цекосигмоанастомоз.
Резекция сигмовидной кишки.
Возможная локализация опухоли: дистальная треть сигмовидной кишки.
Лигируемые сосуды – нижние брыжеечные.
При выборе уровня лигирования нижней брыжеечной артерии следует соблюдать баланс между риском повреждения левого гипогастрального нерва (сплетения) и целесообразностью лимфодиссекции апикального лимфатического узла (D3). Варианты снижения риска повреждения левого гипогастрального нерва:
– четкая визуализация левого гипогастрального нерва при перевязке нижней
брыжеечной артерии у аорты
– перевязка нижней брыжеечной артерии на расстоянии 0,5-1,5 см от ее основания с (или без) отдельной лимфодиссекцией апикальных лимфоузлов (253).
Объем лимфодиссекции:
D2 – 241 группа (эпиколические и параколические), 242 группа (лимфоузлы сигмовидных артерий), 252 группа (лимфоузлы нижней брыжеечной артерии).
D3 – дополнительно 253 группа (лимфоузлы нижней брыжеечной артерии проксимальнее места отхождения левой ободочной артерии).
Проксимальная граница резекции – нисходящая ободочная кишка.
Дистальная граница резекции – ректосигмоидный отдел.
Анастомоз: десцендоректоанастомоз.
Термин «передняя резекция прямой кишки» используется только при операциях по удалениию опухолей, расположенных ниже (и включая) ректосигмоидного отдела, и не используется при удалении опухолей сигмовидной кишки несмотря на формирование анастомоза с прямой кишкой.
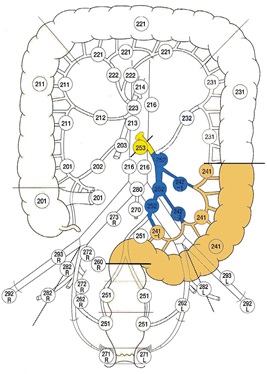
Рис.10. Резекция сигмовидной кишки
Рак ободочной кишки, осложненный непроходимостью
1. При опухолях правой половины ободочной кишки с непроходимостью выполняется правосторонняя гемиколэктомия с формированием илеотрансверзоанастомоза. Операция может включать интраоперационную декомпрессию.
2. При опухолях левой половины кишки, осложненных непроходимостью, возможны несколько вариантов. У пациентов высокого риска несостоятельности анастомоза:
– резекция кишки с колостомией (операция Гартмана)
– эндоскопическая декомпрессия (стентирование).
У больных крайне высокого риска:
– эндоскопическая декомпрессия (стентирование)
– колостомия.
У остальных пациентов:
– интраоперационная декомпрессия, резекция кишки в адекватном объеме с
формированием первичного анастомоза.
ВЫБОР ТАКТИКИ ЛЕЧЕНИЯ В ЗАВИСИМОСТИ
ОТ СТАДИИ РАКА ОБОДОЧНОЙ КИШКИ
Рак ободочной кишки TisN0M0 и T1N0M0 («ранний рак»)
В рамках термина «ранний рак ободочной кишки» выделяют:
– Tis – рак in situ - интраэпителиальный, или инвазия собственной пластинки
– T1 – опухоль инфильтрирует слизистую оболочку и подслизистый слой.
При раннем раке ободочной кишки с максимальным диаметром поражения свыше 2 см в диаметре эндоскопическая резекция не выполняется, и пациенту предлагается оперативное лечение.
При раннем раке ободочной кишки с максимальным диаметром поражения до 2 см в 1 линии лечения могут использоваться внутрипросветные эндоскопические вмешательства. Предпочтение следует отдавать эндоскопической подслизистой диссекции (ESD).
После получения результатов морфологического исследования удаленного препарата принимается решение об окончании лечебной программы (Тis, высокая или умеренная степень дифференцировки опухоли, отсутствие венозной или лимфатической инвазии) или о планировании резекции ободочной кишки (отсутствие любого из трех критериев).
Рак ободочной кишки Т1-2N0M0
Приоритет лапароскопической резекции ободочной кишки с лимфодиссекцией D2. Открытая операция выбирается в случае дооперационных или интраоперационных факторов риска лапароскопического подхода:
– ожирение
– спаечный процесс
– анатомические особенности (мегаколон)
– тяжелая дыхательная недостаточность.
Адъювантная химиотерапия не требуется.
Рак ободочной кишки Т3-4N0M0
1. Резекции ободочной кишки с лимфодиссекцией D2-D3.
2. Адъювантная химиотерапия в группе высокого риска распространения.
Рак ободочной кишки Т3-4N1-2M0
1. Резекция ободочной кишки с лимфодиссекцией D2-D3.
2. Адъювантная химиотерапия.
Рак ободочной кишки Т3-4N1-2M1
Тактика лечения больных с метастатическим колоректальным раком принимается на основе междисциплинарного обсуждения (хирургов, гепатохирургов, онкологовхимиотерапевтов).
1. Резекция ободочной кишки с лимфодиссекцией D2. Решение о симультанной резекции печени основывается на клинических и ренгенангиографических критериях резектабельности метастазов. Пациенты с одиночными или монолобарными метастазами, которые перенесли радикальное лечение по поводу колоректального рака, являются кандидатами на резекцию печени. Противопоказания к резекции печени: канцероматоз, распространенное поражение лимфоузлов (наличие забрюшинных,
медиастинальных, портальных лимфоузлов), метастазы в кости или ЦНС.
2. Лечебная химиотерапия.
СОВРЕМЕННАЯ СТРАТЕГИЯ ЛЕЧЕНИЯ РАКА ПРЯМОЙ КИШКИ.
Приоритетными направлениями в терапии злокачественных опухолей различных локализаций, в том числе и рака прямой кишки, являются разработка и внедрение комплексных программ, направленных на улучшение отдаленных результатов лечения.
Поводом повышенного интереса к лечению данной патологии является с одной стороны неуклонный рост заболеваемости, а с другой - отсутствие улучшения отдаленных результатов хирургического лечения рака прямой кишки.
Основная причина такой ситуации - высокая частота возникновения регионарных рецидивов рака (у 20-40 % оперированных больных) после выполнения, казалось бы, радикальных оперативных вмешательств. Это не позволяет превысить показатели 5-летней выживаемости выше 55-60 % при хирургическом лечении. Основной причиной неудовлетворительных отдаленных результатов лечения рака данной локализации является высокая запущенность опухолевого процесса, тесная лимфогематогенная взаимосвязь опухолей прямой кишки с органами мочеполовой системы, что и обуславливает высокую вероятность распространения элементов опухоли на окружающие органы и ткани.
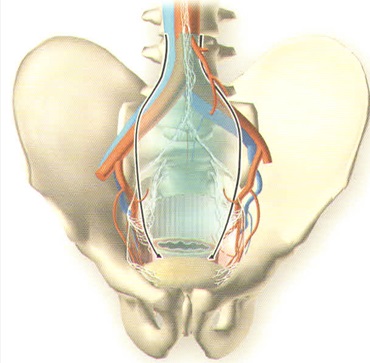
Важнейшим стратегическим направлением онкопроктологии является разработка комплексных программ, направленных на профилактику рецидивов рака прямой кишки. В патогенезе развития локорегиональных рецидивов рака прямой кишки ведущая роль принадлежит распространению опухолевых клеток по лимфатическим коллекторам и узлам малого таза, причем, рецидивы могут возникать как из пораженных метастазами лимфатических узлов параректальной клетчатки - лимфатических узлов Герота (мезоректума), так из лимфатических узлов малого таза - наружных, внутренних подвздошных и обтураторных.
Лимфатические узлы параректальной клетчатки являются первым этапом метастазирования рака и подлежат удалению вместе с параректальной клетчаткой (мезоректумом) при выполнении стандартных оперативных вмешательств. При этом объем удаляемой параректальной клетчатки напрямую зависит от характера выполняемой операции. Так при органосохраняющих операциях, особенно при среднеампулярной локализации опухолевого процесса, сохраняется дистальная часть мезоректальной клетчатки (нарушение принципа тотальной ме- зоректумэктомии) с пораженными, пальпаторно не определяемыми лимфатическими узлами, которые могут служить источником возникновения рецидивов рака. Соблюдение принципа тотальной мезоректумэктомии при выполнении операций на прямой кишке, особенно сфинктеросохраняющих по поводу рака средне- и нижнеампулярного отделов является обязательным условием.
Другим источником возникновения рецидивов могут служить многочисленные группы лимфатических узлов малого таза (сакральные, по ходу наружных, внутренних подвздошных сосудов), которые являются, как известно, вторым этапом метастазирования при раке прямой кишки. Данная группа регионарных лимфатических узлов не удаляется при выполнении стандартных по объему оперативных вмешательств, в то время как их метастатическое поражение является одним из факторов в патогенезе образования локорегионарных рецидивов рака. Учитывая местный характер развития рецидивов рака прямой кишки, решающую роль в профилактике отводится проведению предоперационной (неоадъювантной) химиолучевой терапии с полирадиомодификацией (одновременное или последовательное применение двух и более однонаправленных или разнонаправленных радиомодулирующих агентов для максимального расширения терапевтического интервала между лучевым поражением опухолей и нормальных тканей), разработанную в отделении онкопроктологии РОНЦ им. Н.Н. Блохина. Основной целью программы полирадиомодификации является улучшение отдаленных результатов комбинированного метода лечения за счет повышения эффективности предоперационной лучевой терапии.
Особенно этот подход оправдан при запущенных опухолях.
Предоперационное лучевое лечение.
В зависимости от целей, с которыми его назначают, можно выделить две основные формы:
- облучение операбельных форм колоректального рака;
- облучение неоперабельных или сомнительно операбельных
опухолей.
Анализ имеющихся экспериментальных и клинических данных показывает, что в основе развития местных рецидивов и отдаленных метастазов после радикальных оперативных вмешательств лежат процессы, во-первых, связанные с биологическими особенностями течения опухолевого процесса и, во-вторых, с техникой выполнения операций: пробы крови, оттекающей из зоны оперативных вмешательств, демонстрируют появление в ней повышенного числа опухолевых клеток.
Предоперационное облучение ведет к изменению биологических свойств злокачественной опухоли вследствие разрушения радиочувствительных клеток, нарушения их способности к репродукции и имплантации. При облучении зон клинического и субклинического распространения опухоли перед хирургическим вмешательством достигается прежде всего летальное повреждение высокозлокачественных пролиферирующих клеток, большая часть которых расположена в хорошо оксигенированных периферических участках опухоли, в зонах ее роста как в первичном очаге, так и в метастазах. Определенную степень летальных и сублетальных повреждений получают и неразмножаюшиеся комплексы раковых клеток, благодаря чему снижается их способность к приживлению в случаях попадания в рану, кровеносные и лимфатические сосуды. Гибель опухолевых клеток в результате лучевого воздействия приводит к уменьшению размера опухоли, отграничению от окружающих нормальных тканей за счет разрастания соединительнотканных элементов (в случаях длительного предоперационного облучения и отсроченных операций). При морфологическом и авторадиографическом исследовании удаленных опухолевых тканей отмечается повышение степени дифференцировки в результате гибели анаплазированных, более радиочувствительных клеток. Признаки лучевого поражения опухолей обычно выражаются в усилении дистрофических и некробиотических процессов: исчезновении митозов, дискомплексации раковых клеток, усилении плазмоцитарной и гистиоцитарной инфильтрации стромы, пролиферации фибробластов, нарастании склероза и др. Все эти факторы создают условия для увеличения резектабельности, повышают возможность абластичного выполнения оперативных вмешательств, уменьшая угрозу развития рецидивов и метастазов.
Следует также учитывать, что наибольшее влияние на улучшение результатов локального излечения карциномы лучевая терапия оказывает тогда, когда выполняются условия, при которых проявляется основное преимущество ее перед оперативным вмешательством - возможность более широкого локального противоопухолевого воздействия. При колоректальном раке в объем облучения обязательно включается не только первичный очаг, но и зоны субклинического распространения опухоли по толстой или прямой кишке и по прилежащим нормальным тканям, а также лимфатические узлы первого и второго порядка, которые в ряде случаев полностью удалить не удается. Так, при раке прямой кишки верхняя граница мишени, подлежащей облучению, находится на уровне Lv: латеральные - на 2 см кнаружи от передней поверхности костей таза; нижняя - должна включать ткани промежности. Передняя граница располагается таким образом, чтобы в зону лучевого воздействия попадали внутренние и наружные подвздошные лимфатические узлы. Задняя граница мишени наиболее важная потому, что прямая кишка и параректальная клетчатка располагаются в ее зоне в непосредственной близости к крестцу и копчику. Поэтому край заднего поля по крайней мере должен быть в 2 см кзади от передней поверхности крестца. Вся область крестца должна включаться в зону облучения у больных с местнораспространенной опухолью для уменьшения вероятности рецидива, распространяющегося вдоль нервных корешков.
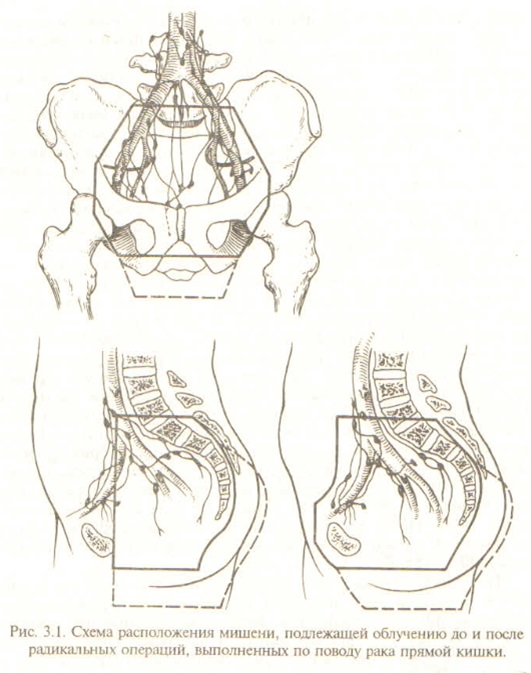
При оперативном вмешательстве, выполненном по поводу местно-распространенного рака прямой кишки, производят удаление основного массива опухоли, т. е. той части новообразования, которая практически не может быть разрушена полностью без подведения высоких доз ионизирующих излучений. Подведение последних связано с большими трудностями, обусловленными относительно невысокой лучевой толерантностью прилежащих органов и тканей и прежде всего мочевого пузыря. Поэтому при раке прямой кишки более радикальным и надежным методом лечения является комбинированный. Повышение резектабельности и радикальности местного удаления первичной опухоли и регионарных метастазов ведет к повышению эффективности терапии больных колоректальным раком.
Лучевая терапия как компонент комбинированного лечения позволяет расширить показания к радикальному лечению местнораопространенных опухолей, повысить резектабельность и онкологическую радикальность операций, снизить частоту развития местных рецидивов при раке прямой кишки, способствует повышению положительных результатов при выполнении органосохраняющих хирургических вмешательств, даже при локализации рака в нижнеампулярном отделе прямой кишки. Так, предоперационное облучение в дозе 25 Гр ( 40 изоГр), подведенной за 5 дней, в сочетании с локальной гипертермией позволило снизить число рецидивов.
Реализация положительного эффекта предоперационной лучевой терапии определяется прежде всего величиной дозы облучения. Хотя ряд вопросов относительно величины и временного ее распределения все еще находится в стадии изучения, накопленный клинический опыт позволяет установить некоторые факторы, которыми можно руководствоваться при выборе величины дозы.
Во-первых, доза должна быть достаточной, чтобы вызвать гибель большей части клеток опухоли, несущих опасность диссеминации во время операции.
Во-вторых, она не должна вызывать заметных изменений в нормальных тканях, которые могли бы вызвать нарушение процессов заживления послеоперационных ран и увеличение послеоперационной смертности.
Исходя из первого положения, можно сделать вывод о том, что лучевое лечение может быть реально эффективным только при подведении к опухоли достаточно высокой дозы облучения. Однако это требование лимитируется необходимостью сохранения репаративных способностей нормальных тканей.
Многолетний опыт использования комбинированного лечения показывает, что очаговая доза не более 40 Гр, подведенная по 4 Гр ежедневно в течение 4 недель (10 сеансов – 3 раза в неделю), не вызывает сложностей в выполнении последующей операции и не оказывает заметного влияния на заживление послеоперационной раны.
При этом суммарная очаговая доза (СОД) облучения должна составлять не менее 40 изоГр при различных режимах фракционирования, а объем облучения должен включать все регионарные лимфатические узлы - как первого, так и второго этапов потенциального метастазирования.
Использование в предоперационном периоде только лучевой терапии обладает недостаточным канцероцидным воздействием. Особенно это касается радиорезистентных гипоксических клеток - как первичной опухоли, так и метастазов в регионарных лимфатических узлах (радиорезистентность злокачественных опухолей в значительной степени определяется наличием в них фракций гипоксических клеток, возникающих из-за неполноценности системы микроциркуляции новообразований и обладающих повышенной устойчивостью к действию ионизирующей радиации).
Поэтому поиск программ улучшения результатов комбинированного лечения рака прямой кишки должен быть направлен не на наращивание поглощенной суммарной очаговой дозы излучения, а на повышение эффективности лучевого компонента за счет усиления избирательного повреждения фракции радиорезистентных гипоксических опухолевых клеток.
Одним из перспективных способов преодоления радиорезистентности в процессе лучевой терапии является использование радиомодификаторов, которые обеспечивают избирательное повышение радиочувствительности опухолевых клеток.
К числу таких радиомодификаторов относятся:
1. гипертермия (ГТ),
2. электронно-акцепторные соединения (ЭАС),
3. некоторые химиопрепараты.
Гипертермия.
Одним из перспективных путей повышения эффективности лучевой терапии является применение гипертермического воздействия в качестве радиомодификатора. Широкому применению терморадиотерапии способствовала также разработка отечественного оборудования для электромагнитной гипертермии, которая позволяет избирательно повышать температуру ткани в опухоли, не вызывая при этом критического нагревания окружающих здоровых тканей. Из применяемых в онкологической практике электромагнитных излучений наиболее приемлемым в лечении рака прямой кишки является СВЧ-излучение с диапазоном частоты от 450 до 915 МГц, так как при этом довольно равномерно можно нагреть опухоли на глубине до 2-3,5 см.
В основе применения гипертермического воздействия лежит положение об избирательном поражающем действии повышенной температуры на опухолевые клетки по сравнению с нормальными. В настоящее время не вызывает сомнения, что радиорезистентность опухоли в основном определяется наличием в ней гипоксических клеток, и для их необратимого повреждения необходимо подведение довольно высокой поглощенной дозы, что в клинических условиях удается далеко не всегда. При действии температурных режимов (выше 40,5—41 °С) именно эти клетки оказываются наиболее уязвимыми.
Другой важной предпосылкой сочетанного действия лучевой терапии и гипертермии является селективное повреждающее действие повышенной температуры на опухоль, преимущественно в радиорезистентной S-фазе клеточного цикла. Таким образом, при термолучевой терапии происходит как бы суммация повреждений от обоих лечебных факторов. Различие в термочувствительности также обусловлено особенностями васкуляризации опухолей и уровнем их кровоснабжения. За счет различий в кровотоке разность температуры опухоли и окружающих ее здоровых тканей может достигать нескольких градусов. Из чего же складывается эффективность сочетанного действия гипертермии и лучевой терапии? Наиболее существенным при совместном действии данных лечебных агентов, особенно в умеренных температурных режимах, является эффект гипертермической радиосенсибилизации, которая реализуется несколькими путями.
В механизме радиосенсибилизирующего действия гипертермии большинство исследователей наиболее важным считают возможность инактивации процессов репарации сублетальных и потенциально летальных пострадиационных повреждений. Установлено, что при температурах 37 и 41 °С еще происходит репарация ДНК в облученных клетках, при температуре 43 °С репаративные процессы полностью приостанавливаются, а при температуре 45 "С происходит дополнительная деградация ДНК.
Еще одним аспектом сенсибилизирующего действия гипертермии, по мнению ряда авторов, является способность ее при некоторых опухолях накапливать клетки в радиочувствительные фазы G1 и G2 и в фазе митоза, в основном за счет уменьшения количества клеток в радиорезистентном S-периоде.
Таким образом, в механизме радиосенсибилизирующего действия гипертермии можно выделить следующие основные моменты:
1. Инактивация процессов репарации сублетальных и потенциально летальных пострадиационных повреждений;
2. Прямое термическое воздействие на гипоксические клетки опухоли;
3. Патологически измененные сосуды, в опухолевой ткани за счет несовершенного мышечного слоя, не обеспечивают адекватную терморегуляцию, что приводит к перегреванию опухоли и нарушению рН среды в кислую сторону;
4. Перевод клеток опухолей в радиочувствительные фазы G1-2 и М клеточного цикла, в основном - за счет уменьшения количества клеток, находящихся в радиорезистентной S-фазе.
Наиболее широкое применение в клинической онкологии гипертермия нашла после внедрения методов внутритканевой генерации тепла, к которым относят нагревание с помощью электромагнитных полей радиочастотного диапазона, лучистой энергии и ультразвука. Выделяют: СВЧ (сверхвысокочастотные), УВЧ (ультравысокочастотные) и ВЧ (высокочастотные) излучения. Электромагнитные поля в ткани организма вызывают генерацию тепла, и тем самым происходит не просто передача тепла, а прогревается весь объем тканей, попадающих в зону электромагнитного излучения. При этом если в здоровых тканях с достаточно выраженным кровоснабжением происходит интенсивный отвод тепла, еще более усиливающийся под воздействием гипертермии, то в опухоли из-за плохого кровоснабжения наблюдается преимущественное накопление энергии.
Внутриполостную СВЧ - гипертермию осуществляют с частотой электромагнитных колебаний 460 и 915 МГц в течение 60 мин на аппарате "Ялик". Для внутриполостной СВЧ - гипертермии применяют специальные антенны-излучатели. Локальную СВЧ - гипертермию через крестец осуществляют с частотой электромагнитных колебаний 40 МГц на аппарате "Экран-2" и "Ягель" с длительностью процедуры 60 мин.
Для проведения внутриполостного прогревания излучатели имеют водяное охлаждение для снижения температуры на подлежащей слизистой оболочке. Сеанс гипертермии начинают без включения охлаждения. Через 3-5 мин температура на слизистой оболочке и в опухоли достигает 42,5-43°С, затем включают водяное охлаждение, и температура на слизистой оболочке снижается до 40-41 "С, а температура в опухоли остается на прежнем уровне.
Таким образом, применение разработанной методики сочетанного применения локальной СВЧ - гипертермии и предоперационного облучения позволяют повысить эффективность комбинированного лечения больных раком прямой кишки.
Однако применение одного радиомодификатора в сочетании с лучевой терапией не всегда эффективно из-за невозможности достижения необходимого уровня радиосенсибилизации для всего пула опухолевых клеток. Поэтому дальнейшие перспективы повышения эффективности комбинированного метода лечения связаны с созданием и реализацией программы полирадиомодификации с включением в схему неоадъювантной лучевой терапии двух и более радиомодифицирующих агентов.
Электронно-акцепторные соединения.
Радиомодифицирующими агентами, которые обладают необходимым уровнем радиосесибилизации, а также при совместном применении с другими радиомодификаторами оказывает синергическое воздействие (суммация эффекта воздействия) являются электроноакцепторные соединения (ЭАС) - в частности, метронидазол.
Основные механизмы действия метронидазола как электронно-акцепторного соединения.
1. радиационно-химический - «фиксация» лучевых повреждений ДНК за счет высокого сродства МЗ к электрону («быстрый» механизм радиосенсибилизации);
2. цитотоксический - избирательная гибель радиорезистентных, гипоксических клеток («медленный» механизм радиосенсибилизации);
3. биохимический («медленный» механизм радиосенсибилизации);
4. блокирование процессов репарации сублетальных и потенциально летальных повреждений опухолевых клеток.
Метронидазол (МЗ) - препарат, используя который в качестве радиосенсибилизатора гипоксических фракций опухолевых клеток, удается достоверно улучшить результаты лучевого лечения при целом ряде злокачественных новообразований.
С учетом общего состояния больных созданы два варианта полирадиомодификации в программе комбинированного лечения рака прямой кишки. Методика "жесткого" режима программы полирадиомодификации заключается в двукратном внутриректальном подведении полимерной композиции (на 3 и 5 сеансах лучевой терапии), содержащей МЗ в дозе 10 г/м2 поверхности тела (в среднем от 18 до 22 г МЗ), с экспозицией ее в прямой кишке в течение пяти часов с последующим проведением сеанса лучевой терапии и внутриректальной СВЧ-гипертермии. "Щадящий" режим предполагает однократное подведение полимерной композиции с МЗ в сочетании с локальной внутриполостной СВЧ-гипертермией.
При выборе других радиомодулирующих агентов было обращено внимание на то, что химические соединения разных классов усиливают радиационное повреждение ДНК опухолевой клеток и тем самым повышают эффективность радиотерапии опухолей, т.е. выступают как радиосенсибилизаторы. Такими химиотерапевтическими препаратами, активными при этой форме опухолей, являются антиметаболиты из группы фторпроизводных пиримидина. Мишенью фторпиримидиновых препаратов является фермент тимидилатсинтетаза (ТС), который является ключевым звеном в механизме гибели опухолевой клетки. К фторпиримидиновым соединением относятся антиметаболиты фторпиримидинового ряда: 5-фторурацил и его аналоги (Капецитабин, Фторафур, Тегафур).
Однако сами по себе химиотерапевтические препараты этой группы обладают относительно невысокой противоопухолевой активностью, что не позволяет рассчитывать на получение достаточно выраженного радиосенсибилизирующего эффекта. Усилить радиосенсибилизирующий эффект, возможно, при совместном применении 5-фторурацила и ЭАС (метронидазол). Для снижения токсичности использован 5-фторурацил в пероральной неактивной форме (Капецитабин; Xeloda), превращающейся в 5-фторурацил преимущественно в опухоли посредством тимидинфосфори лазы (ТФ) с минимальной его концентрацией в плазме.
Перспективы дальнейшего совершенствования программы полирадиомодификации находятся в диапазоне создания многокомпонентных программ (использование трех и более компонентов) в схеме комбинированного и комплексного лечения. Другим направлением совершенствования программы полирадиомодификации является повышение эффективности отдельных радиомодифицирующих компонентов лучевого воздействия в программе комбинированного лечения рака данной локализации. В частности в этом направлении при двухкомпонентной программе полирадиомодификации обосновано повысить эффективность именно лекарственного компонента для усиления системного воздействия на диссеминированные опухолевые клетки и снижения частоты гематогенных метастазов.
Внедрение программы полирадиомодификации позволило снизить частоту лимфогематогенного метастазирования, предотвратить развитие локорегионарных рецидивов и существенно улучшить показатели безрецидивной выживаемости больных. Комбинированное лечение рака прямой кишки с использованием программы полирадиомодификации, существенно повышая радикализм оперативных вмешательств, позволяет расширить показания к выполнению сфинктеросохраняющих операций, особенно при локализации опухоли в нижне- и среднеампулярном отделах прямой кишки.
КЛАССИФИКАЦИЯ ОПЕРАТИВНЫХ ВМЕШАТЕЛЬСТВ ПРИ РАКЕ ПРЯМОЙ КИШКИ
В настоящее время в распоряжении хирурга имеется достаточно большой арсенал хирургических вмешательств при раке прямой кишки, особенно ее нижнеампулярного отдела; ранее традиционная стандартная операция заканчивалась формированием противоестественного заднего прохода на передней брюшной стенке, что неизбежно приводило к инвалидизации больных. Внедрение в схему лечения рака прямой кишки программы предоперационной терморадиохимиолучевой терапии позволило расширить показания для сфинктеросохраняющих операций, увеличить показания к выполнению операций, направленных на восстановление естественного пассажа по толстой кишке.
СТАНДАРТНЫЕ ОПЕРАЦИИ:
1. Экстирпация прямой кишки.
2. Брюшно-анальная резекция прямой кишки с низведением сигмовидной ободочной.
3. Чрезбрюшная резекция прямой кишки.
4. Операция Гартмана.
ОПТИМАЛЬНАЯ УКЛАДКА БОЛЬНОГО ДЛЯ ВЫПОЛНЕНИЯ РАДИКАЛЬНЫХ ОПЕРАЦИЙ
Успех любой операции зависит, прежде всего, от квалификации хирурга, от правильно выбранных его действий, начиная от укладки больного на операционный стол и выполнения различных простых и сложных манипуляций при проведении хирургического вмешательства. Даже небольшие отклонения от основных принципов могут привести к серьезным осложнениям.
Для того чтобы обеспечить постоянную эвакуацию мочи и, следовательно, хороший обзор зоны малого таза, мочевой пузырь катетеризируется перед вмешательством. По окончании операции катетер оставляют в мочевом пузыре и удаляют через 2-3 суток.
Больного укладывают на операционный стол так, чтобы хирургу было возможно подойти к операционному полю с любой стороны и выполнять операцию в удобных для него условиях.
ЭКСТИРПАЦИЯ ПРЯМОЙ КИШКИ
После проведенной ревизии органов брюшной полости и установления ранорасширителей для создания хорошей экспозиции петли тонкой кишки оттесняют вверх влажной пеленкой, изолируя брюшную полость от полости таза. Затем лирообразным разрезом рассекается тазовая и париетальная брюшина с двух сторон у основания брыжейки сигмовидной кишки.
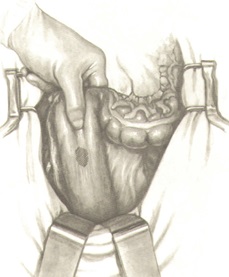
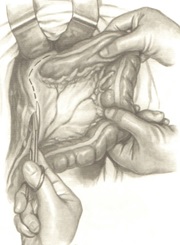
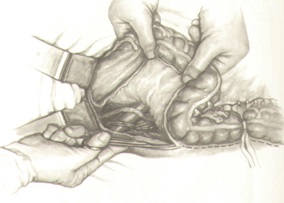
Выделяются нижняя брыжеечная артерия и вена пересекаются между зажимами и перевязываются дистальнее отхождения левой ободочной артерии, расправляется брыжейка до нужной длины.
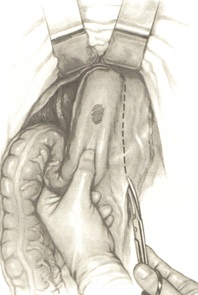
Пересекается краевой сосуд. Затем участок кишки, расположенный не менее чем на 10-15 см выше верхнего полюса опухоли, очищается от брыжейки и жировых подвесок на протяжении 5—6 см.
На этом уровне кишка изолируется марлевыми салфетками от брюшной полости и после наложения кисетных швов пересекается между сшивающими аппаратами (УО-40-60).
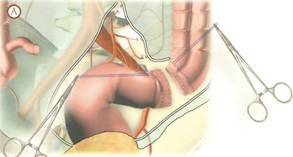

Выделение кишки с опухолью является самым важным этапом операции. Мобилизация ее производится острым путем под контролем зрения. Вначале рассекается фасциальная оболочка у основания брыжейки сигмовидной кишки так, чтобы попасть между собственной фасцией прямой кишки и передней фасцией крестца. Оперирующий хирург одной рукой подтягивает и оттесняет кпереди заднюю полуокружность прямой кишки, а другой рукой выделяет ее сзади, рассекая ножницами или электроножом ткани вплоть до диафрагмы таза. При этом, прежде всего, необходимо сохранять фасцию, покрывающую мезоректум, для того, чтобы предотвратить диссеминацию раковых клеток при манипуляциях на кишке, несущей опухоль, а также повреждение крестцовых вен, парасимпатических и симпатических нервов, контролирующих половую функцию и функцию мочевого пузыря.
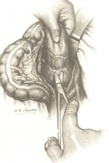
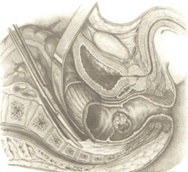
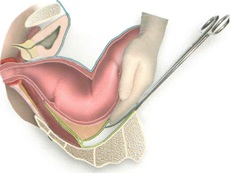
После этого осуществляется мобилизация боковых полуокружностей тазовой части прямой кишки. Необходимо учесть, что при выделении данного участка кишки существует опасность ранения мочеточников, особенно слева, или повреждение крупных сосудов, расположенных на стенке таза. Для предупреждения этих осложнений выделяются мочеточники вместе с сосудами и отводятся крючками латерально. Прямая кишка оттягивается в противоположную сторону, после чего под контролем зрения выделяются боковые ее полуокружности до тазового дна, не вскрывая собственную фасцию. После перевязки или коагуляции пересекаются средние прямокишечные сосуды.
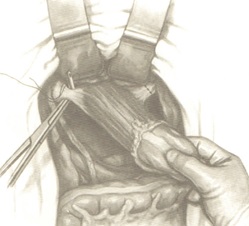
Наиболее трудным этапом при выделении прямой кишки является мобилизация ее передней полуокружности, особенно в тех случаях, когда опухоль расположена близко к влагалищу у женщин, к предстательной железе у мужчин. В этой ситуации мочевой пузырь у мужчин, матка с придатками у женщин поднимаются длинным зеркалом и отводятся кпереди, а кишка оттесняется к крестцу. Осторожно ножницами, а лучше электроножом, пересекаются поэтапно ткани до верхнего края анального канала. В этой области границей выполнения мезоректумэктомии служит фасция Денопвилье-Салищева.
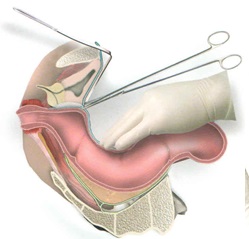
Если опухоль имеет большие размеры, глубоко врастает в клетчатку или окружающие ткани и закрывает собой операционное поле, то в этом случае можно выделить кишку тупым и острым путем, пересекая ткани под контролем пальца. Надо помнить, что в этих условиях увеличивается риск возникновения опасных кровотечений или вскрытия просвета кишки.
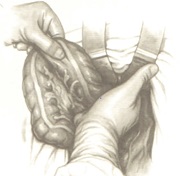

После выделения прямой кишки с опухолью со стороны брюшной полости приступают к выполнению этапа операции со стороны промежности. Для этого ушивается заднепроходное отверстие кисетным швом, отступя 3-4 см от наложенного шва, делается круговой разрез кожи и подкожной жировой клетчатки. Кожные края противоположных сторон сшиваются узловыми швами.
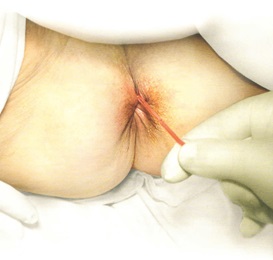
После рассечения подкожной жировой клетчатки до тазового дна сзади по средней линии рассекается копчиково-анальная связка.
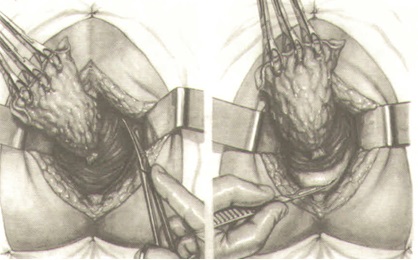
Осторожно зажимом хирург проникает в полость таза позади прямой кишки и выделяет сначала справа, а затем слева мощные заднебоковые порции мышцы, поднимающей задний проход, накладывая на них зажимы как можно ближе к стенке таза, рассекает и перевязывает рассасывающейся лигатурой. Наиболее трудным этапом операции при выполнении ее со стороны промежности является выделение передней полуокружности. В этой области выделять следует только острым путем очень осторожно и стараться попасть в слой рыхлой соединительной ткани, находящейся между прямой кишкой и прилежащими органами. Если не соблюдать эти принципы, то можно вскрыть просвет кишки или мочеиспускательного канала у мужчин, влагалища у женщин, а также вызвать опасное кровотечение в результате травмы предстательной железы. После мобилизации кишки по передней полуокружности выделяются оставшиеся передне-боковые порции мышцы, поднимающей задний проход, пересекаются по очереди на зажимах, прошиваются и перевязываются лигатурой. Мобилизованная кишка удаляется через рану промежности.
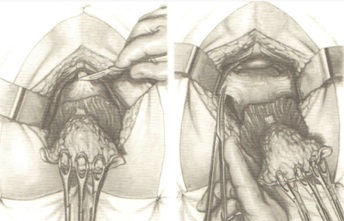
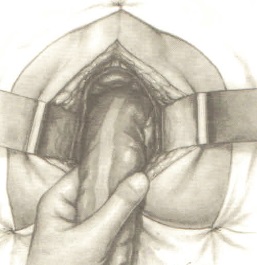
После ревизии и тщательно проведенного гемостаза полость таза промывается большим количеством (3—5 литров) антисептических растворов. Промывание проводится с целью очистки полости таза от сгустков крови, лимфы и возможно свободно лежащих раковых клеток, что является мерой профилактики имплантационного метастазирования и гнойных осложнений.
Далее со стороны промежности через дополнительные проколы кожи и подкожной жировой клетчатки вводятся слева и справа от раны в пресакральную ямку две дренажные трубки. Через них производится дренирование полости малого таза в послеоперационном периоде. Затем рана промежности ушивается наглухо.
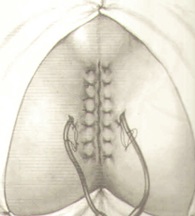
Со стороны брюшной полости восстанавливается целостность тазовой брюшины. При выполнении этого этапа следует быть особенно внимательным во избежание прокола мочеточника или вовлечения его в лигатуру, гак как иногда он близко располагается к линии разреза брюшины. В случаях широкого иссечения тазовой брюшины при распространенном опухолевом процессе сшить ее края бывает трудно. Тогда можно отсепаровать брюшину от боковых стенок таза и ушить ее. Однако если все-таки остается дефект, то для его закрытия можно использовать у женщин матку с придатками, у мужчин - сальник. Но если и это не удается, то можно оставить брюшину не ушитой. Тогда исключается орошение полости малого таза в послеоперационном периоде, а дренажные трубки, если нет отделяемого, удаляются на 3-5 сутки.
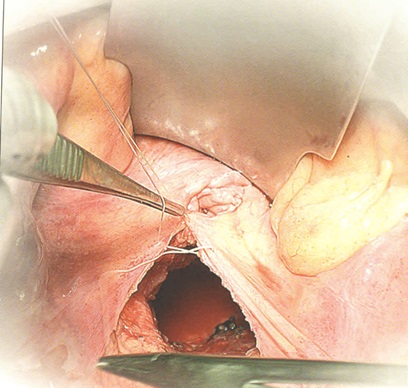
Глухой шов на рану промежности следует накладывать всем больным, за исключением тех, которым произведена тампонада полости малого таза большими марлевыми салфетками из-за кровотечения, возникшего при мобилизации кишки, которое остановить не удалось ни одним из имеющихся у хирурга способов. В частности, таких, как электрокоагуляция, прошивание сосудов и др.
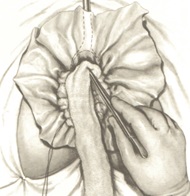
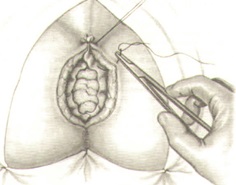
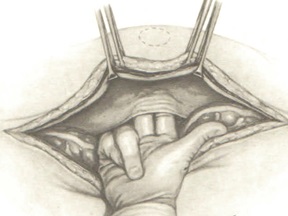
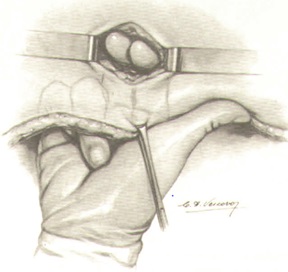
Завершается операция формированием колостомы на передней брюшной стенке. Кишка должна лежать свободно без натяжения, в то же время не должно быть большой петли в брюшной полости для предупреждения образования перегибов, препятствующих в дальнейшем нормальной функции кишечника. Формирование колостомы осуществляется закрытым способом и заканчивается в конце операции, после ушивания лапаротомной раны. Для этого накладываются 8-10 швов между кожей и серозно-мышечным слоем кишки по всему периметру. После чего отсекается культя таким образом, чтобы кишка выступала на 0,5 см над кожей с целью создания оптимальных условий для использования в дальнейшем современных калоприемников на клеящейся основе.
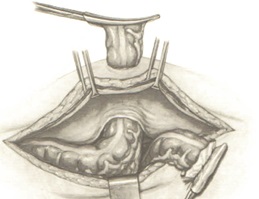
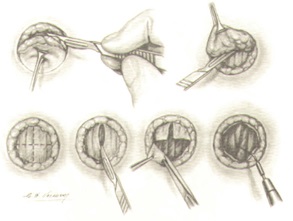
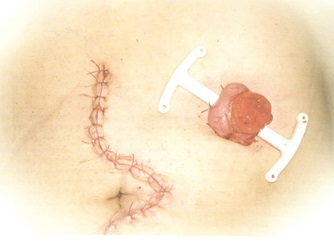
Заканчивается операция послойным ушиванием передней брюшной стенки.
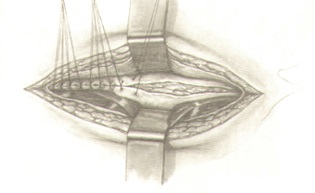
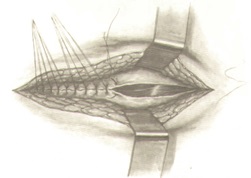
БРЮШНО-АНАЛЬНАЯ РЕЗЕКЦИЯ ПРЯМОЙ КИШКИ С НИЗВЕДЕНИЕМ ОБОЛОЧНОЙ
При выполнении брюшно-анальной резекции ключевыми этапами являются: перевязка сосудов, мобилизация и подготовка ободочной кишки для низведения, формирование колониального анастомоза, дренирование полости таза. После пересечения и перевязки магистральных сосудов очень важным является адекватное расправление брыжейки для низведения. После пересечения сигмовидных артерий, а также бессосудистых участков сигмовидная кишка хорошо расправляется. Если первая сигмовидная артерия отходит от нижней брыжеечной артерии крупным стволом, то снабжение сигмовидной кишки кровью обеспечивается за счет левой и сигмовидной артерий, поэтому очень важно сохранить анастомоз между ними. Если каждая сигмовидная артерия отходит самостоятельно от нижней брыжеечной артерии, то сохранить полноценный краевой сосуд сложно, поэтому требуются определенные навыки, чтобы расправить брыжейку сигмовидной кишки.
Для определения надежности кровоснабжения краевой сосуд рассекается в последнюю очередь между наложенными двумя зажимами. После рассечения сосудов проксимальный зажим расслабляется и при хорошем кровоснабжении появляется пульсирующая струя артериальной крови. В такой ситуации жизнеспособность кишки в новых для нее условиях не вызывает сомнения. Далее участок кишки дистальнее перевязанного сосуда освобождается от брыжейки и жировых подвесков на протяжении 3-4 см, прошивается сшивающими аппаратами и пересекается, культи погружаются в кисетные швы.
Длина сегмента кишки будет достаточной для низведения, если ее конец доходит до середины бедренного треугольника. Выполняется мобилизация прямой кишки с опухолью до анального канала. Кишка ниже опухоли перевязывается лигатурой. Со стороны промежности просвет кишки ниже лигатуры и анальный канал промываются антисептическим раствором. Делается небольшая дивульсия анального жома и вводится анорасширитель так, чтобы была видна зубчатая линия.
Выше аноректальной линии на 1-1,5 см рассекается слизистая и мышечная оболочки прямой кишки по периметру, проксимальный ее край захватывается зажимами Бильрота. Производится выделение кишки до проникновения в полость газа и соединения с абдоминальной бригадой хирургов. Выделенная кишка с опухолью удаляется через брюшную полость. В результате полость таза становится доступной для осуществления тщательного гемостаза и промывания се антисептическими растворами. Установление дренажей проводится следующим образом. Со стороны промежности хирург делает дополнительные разрезы кожи и подкожной клетчатки (1-1,5 см) справа и слева сзади на расстоянии 3-4 см от анального канала. Через эти разрезы со стороны брюшной полости поочередно проводятся дренажные трубки, через которые в послеоперационном периоде 2-3 раза в сутки промывается полость таза антисептическими растворами. Далее трансанально накладывается 8-10 отдельных провизорных швов по периметру оставшегося участка прямой кишки. Подготовленный сегмент кишки низводится в анальный канал и укладывается так, чтобы ее брыжейка была повернута дорзально без перекрута и натяжения. Дренажи укладываются сзади от низведенной кишки, которая должна лежать свободно с образованием небольшой петли на уровне промонториума. Этот момент операции очень важен, так как положение низведенной кишки играет немаловажную роль в восстановлении континенции. При натянутой кишке компенсаторно-приспособительные реакции наступают значительно позже, чем при свободно лежащей. В то же время, если оставлен длинный сегмент, образуются дополнительные петли в полости таза, которые приводят к стойким запорам. После низведения кишки тщательно восстанавливается целостность тазовой брюшины. Передняя брюшная стенка послойно ушивается наглухо.
Большое значение для функции запирательного аппарата имеет способ создания соустья между низведенной кишкой и анальным каналом. Формирование анастомоза конец в конец между низведенной кишкой и анальным каналом в функциональном отношении более выгодно. Для этого со стороны промежности вскрывается просвет низведенной кишки. Затем, отступя от края на 1 см, через все слои снаружи внутрь прошивается кишечная стенка по всему периметру ранее наложенными на верхний край анального канала провизорными лигатурами, швы завязываются в просвет кишки. Таким образом формируется колоанальный анастомоз конец в конец однорядным швом. При выполнении данного анастомоза восстановление функция держания запиратсльного аппарата происходит в срок от 3 до 6 мес.
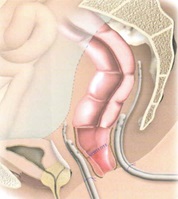
ПЕРЕДНЯЯ РЕЗЕКЦИЯ ПРЯМОЙ КИШКИ С ФОРМИРОВАНИЕМ КОМПРЕССИОННОГО АНАСТОМОЗА
Мобилизация сигмовидной и прямой кишок выполняется таким же образом, как описано в предыдущем разделе. На проксимальный конец сигмовидной кишки накладывается кисетный шов и временно не затягивается. На прямую кишку на 5 см ниже опухоли накладывается Г-образный зажим, дистальнее последнего накладывается кисетный шов.
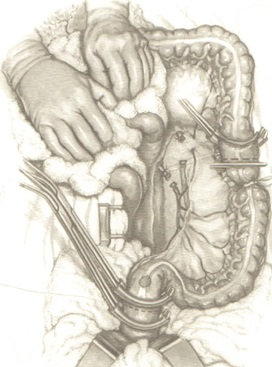
Через анальный канал промывается просвет кишки, затем между зажимом и кисетом пересекается стенка, и операционный препарат удаляется. Через задний проход в кишку вводится сшивающий аппарат для наложения компрессионного анастомоза (АКА-2) или циркулярный сшивающий аппарат (Tyco, Ethicon), на 4-5 см выдвигается его головка. На стержне туго завязывается ранее наложенный на культю прямой кишки кисетный шов, затем ободочная кишка надевается на головку аппарата, и затягивается ранее наложенный на ее конец кисетный шов. Головки сводятся до полной адаптации, и производится прошивание. Фиксирующие кольца (аппарат АКА-2) остаются в области анастомоза в течение 10-14 дней и самостоятельно отторгаются через анальный канал. За этот период времени наступает надежное заживление анастомоза. Важным этапом этой операции является подготовка кишки к формированию анастомоза. Прямая кишка на протяжении 2 см должна быть очищена от мезоректум до мышечного слоя, а сигмовидная - от брыжейки и жировых подвесок, что обеспечивает хорошую адаптацию стенок при прошивании аппаратом и сохраняет их надежное кровоснабжение. В противном случае при недостаточной подготовке из-за интерпозиции жировой ткани происходит неадекватная компрессия кишечных стенок, а очищение кишки на протяжении более 2 см может привести к недостаточному кровоснабжению анастомозируемых участков. Кроме того, следует помнить, что степень компрессии аппарата рассчитана на среднюю толщину кишечной стенки без учета изменений этих показателей, что также может явиться причиной несостоятельности. Как правило, несоответствие диаметров сшиваемых отрезков приводит к гофрированию кишечной стенки кисетным швом, что может также привести к неадекватной компрессии стенки.
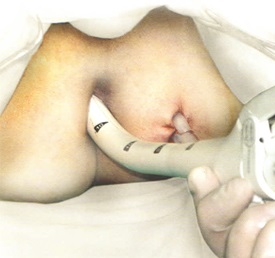
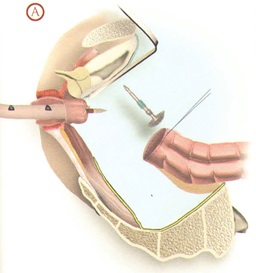
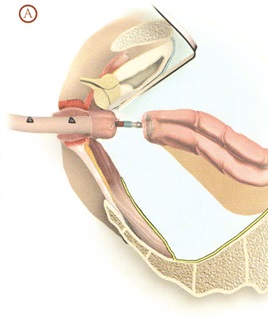
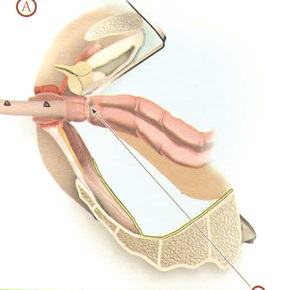
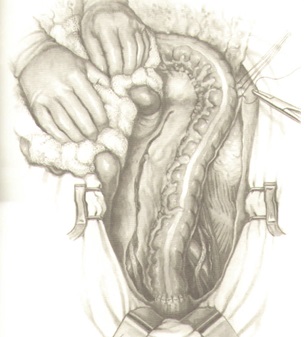
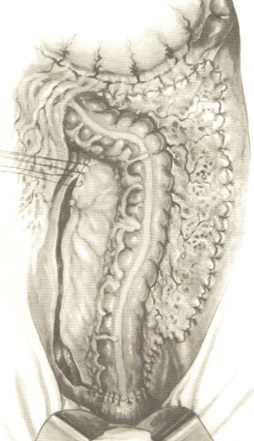
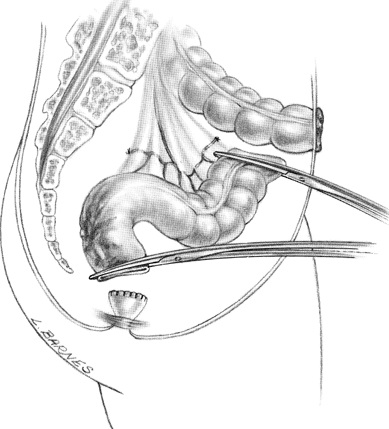
ОПЕРАЦИЯ ГАРТМАНА
Это вмешательство предусматривает резекцию прямой кишки, ушивание ее культи и выведение одноствольной колостомы на переднюю брюшную стенку. Данная операция используется в основном в экстренной хирургии при наличии острой кишечной непроходимости, обусловленной злокачественным новообразованием верхнеампулярного отдела прямой кишки или при возникновении интраоперационных осложнений при выделении прямой кишки с опухолью (вскрытие абсцесса, вскрытие просвета кишки и т.д.). Мобилизация прямой и сигмовидной кишок выполняется таким же образом, как и передней резекции. Только в отличие от нее проксимальный конец сигмовидной кишки выводится на переднюю брюшную стенку и формируется колостома. После наложения Г-образного зажима на прямую кишку на 5 см ниже опухоли последняя прошивается при помощи сшивающего аппарата (УО - 40-60) скрепочным швом, отсекается под зажимом и удаляется. Дополнительных лигатур не накладывают. Над культей прямой кишки ушивается тазовая брюшина после проведения дренажей в полость малого таза со стороны промежности. Для этого прямая кишка острым путем отделяется от крестца до копчика, образуя, таким образом, туннель. Со стороны промежности через разрез кожи и подкожной клетчатки слева от анального канала проводится корнцанг в полость таза. Им захватываются две силиконовые трубки, которые выводятся на промежность и фиксируются лигатурами к коже таким образом, чтобы верхний конец одной из трубок был на уровне культи прямой кишки, другой - на 3 - 4 см ниже. Через три дня трубки удаляются при гладком течении послеоперационного периода. Если же образуется абсцесс или несостоятельности культи кишки, то эти трубки достаточно адекватно осуществляют эвакуацию содержимого полости таза и удаляются по мере затихания воспалительного процесса. Колостома в левой подвздошной области формируется так же, как и при брюшно-промежностной экстирпации прямой кишки.
Послеоперационный мониторинг
После завершения радикального лечения пациенты должные находиться под клиническим наблюдением онкологической службы в течение не менее 5 лет.
Обследование включает:
1. Осмотр онколога: ежегодно.
2. Определение РЭА, СА 19.9: каждые 3-6 месяцев в первые 2 года наблюдения, затем каждые 6 месяцев в течение срока не менее 5 лет после операции.
3. МСКТ или МРТ брюшной полости и малого таза с внутривенным контрастированием, СКТ органов грудной клетки (или рентгенография грудной клетки, УЗИ брюшной полости и малого таза)
– первые 2 года наблюдения: интервал 6 месяцев или раньше при повышении
уровня онкологических маркеров
– 3-5 лет наблюдения: интервал 12 месяцев или раньше при повышении уровня онкомаркеров.
При неубедительных данных МСКТ или МРТ и в случае повышения уровня онкологических маркеров показано проведение ПЭТ с F18 тордезоксиглюкозой.
4. Колоноскопия ежегодно. В случае отсутствия ФКС перед операцией (в связи с непроходимостью) выполнение колоноскопии через 3-6 месяцев после операции.