Непосредственные результаты выполнения робот-ассистированных резекций прямой кишки при доброкачественных и злокачественных новообразованиях
Непосредственные результаты выполнения робот-ассистированных резекций прямой кишки при доброкачественных и злокачественных новообразованиях
С.В. Поздняков1, А.О. Атрощенко1, член-корр. РАН, проф. И.Е. Хатьков1, М.А. Данилов1, З.М. Абдулатипова1, проф. С.М. Чудных2, Ю.А. Стрельцов2, В.С. Егоров2, Г.Г. Саакян2
1ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения г. Москвы
2ГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», Минздрава России, Москва, Россия
Резюме
Последние 15 лет характеризуются активным внедрением роботизированных систем (РС) в колоректальную хирургию. В 2006 г. итальянским хирургом Pigazzi была выполнена первая в мире резекция прямой кишки (ПК) с тотальной мезоректумэктомией с использованием роботизированной системы da Vinci. Операции на ПК имеют целый ряд особенностей, обусловленных узким операционным полем полости малого таза, расположением важных структур вегетативной нервной системы в непосредственной близости от операционного поля, важностью сохранения собственной фасции ПК во время ее мобилизации, при злокачественных заболеваниях ПК, как основного принципа абластики. Появление РС позволило повысить качество и удобство визуализации операционного поля, а лишенные интенционного дрожания манипуляторы – увеличить точность при выделении ПК с сохранением важных структур вегетативной нервной системы.
Изучение непосредственных и отдаленных результатов операций на ПК с использованием РС является актуальным направлением современной хирургии и может быть обоснованием для внедрения этого метода при выполнении наиболее сложных операций.
Ключевые слова: рак прямой кишки, роботизированные операции на прямой кишке.
Введение
История хирургического лечения заболеваний прямой кишки (ПК) насчитывает порядка 300 лет. В 1739 г. Jean Faget выполнил первую экстирпацию ПК, а в 1899 г. английский хирург William Ernest Miles разработал методику экстирпации ПК, которая дошла практически в неизмененном варианте до наших дней [1]. Первую резекцию ПК транссакральным доступом в 1874 г. выполнил Theodor Kocher. Такой метод получил называние задней резекции ПК. Первую же переднюю (чрезбрюшную) резекцию ПК выполнил Carl Gussenuer в 1879 г. Впервые межкишечный анастомоз при резекции ПК был сформирован в 1910 г. хирургом Дональдом Бальфуром [1]. Первое описание методики фасциально-футлярного удаления ПК можно встретить в монографии известного русского хирурга Холдина Семена Абрамовича «Злокачественные новообразования прямой кишки», изданной в 1955 г. В последующем в 1982 г. эта методика была широко растиражирована и запатентована английским хирургом B. Heald как метод удаления ПК с тотальной мезоректумэктомией (TMЭ) [2‒5]. Стандартизация техники фасциально-футлярного удаления ПК открыла новую страницу в хирургическом лечении рака ПК и позволила значительно сократить количество местных рецидивов и тем самым увеличить безрецидивную выживаемость. В период с 1990 по 2000 г. в колоректальную хирургию активно внедряется малоинвазивная лапароскопическая технология [6, 7]. Первую лапароскопическую резекцию ПК успешно провел в 1990 г. Patrick Leahy [6‒8]. Развитие технологического прогресса и появление роботизированных хирургических систем стало новым этапом в развитии инновационных ультрапрецизионных операций на ПК. В 2006 г. итальянский хирург Pigazzi осуществил первую в мире резекцию ПК с TMЭ, используя роботизированную систему (РС) da Vinci [9, 10]. Хирургическая техника при операциях на ПК имеет целый ряд особенностей: ограниченное узкое операционное поле полости малого таза, расположение важных структур вегетативной нервной системы в непосредственной близости от операционного поля, важность сохранения собственной фасции ПК во время ее мобилизации, при злокачественных заболеваниях, как основного принципа онкологической абластики [6, 7, 9]. Появление роботизированных хирургических технологий позволило повысить качество и удобство визуализации операционного поля, а лишенные интенционного дрожания манипуляторы – увеличить точность при выделении ПК с сохранением важных структур вегетативной нервной системы [9, 11‒13].
Изучение непосредственных и отдаленных результатов операций на ПК с использованием РС ‒ актуальное направление современной хирургии и может стать обоснованием для внедрения этого метода при выполнении наиболее сложных операций.
Материал и методы
В исследование включено 26 пациентов, которым в период с сентября 2013 г. по март 2017 г. в колопроктологическом отделении Московского клинического научно-практического центра выполнены операции на ПК по поводу доброкачественных и злокачественных заболеваний с использованием РС da Vinci (Intuitive Surgical, Inc., Sunnyvale, CA, USA).
Все больные обследованы по стандартной схеме, включающей: компьютерную томографию, ультразвуковое исследование органов брюшной полости, колоноскопию, исследование уровня онкологических маркеров крови (РЭА, СА ‒ 19.9) – при злокачественных новообразованиях. Оценка функционального состояния организма осуществлена по шкалам ASA и МНОАР, а также по показателям биохимического и клинического анализов крови. Функции тазового держания оценены с помощью модифицированной шкалы Векснера (WexnerScore), ректальной манометрии, сфинктерометрии. Для оценки мочевыделительной функции использована шкала IPSS (International prostate symptom score ‒ Международная шкала оценки простатических симптомов) и определение остаточного объема мочи. Оценка качества жизни осуществлена по шкале QOL. Для оценки боли использована визуально-аналоговая шкала (ВАШ) интенсивности боли и краткий опросник боли (Вriefpaininventory).
Техника операций. Первые 10 операций были выполнены гибридным способом: первым этапом выполнялась мобилизация левых отделов ободочной кишки лапароскопическим методом, после чего устанавливалась роботизированная платформа da Vinci и выполнялись: этап мобилизации ПК в эмбриональном слое, выделение элементов вегетативной нервной системы, лимфаденэктомия. Остальные 16 операций выполнялись только с использованием РС da Vinci.
На рис. 1 указан способ укладки пациента (в положении Тренделенбурга с разведенными и слегка согнутыми в коленях ногами).
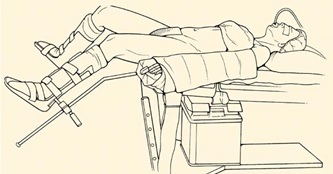
Рис. 1. Положение больного на операционном столе при роботизированных операциях на прямой кишке.
На рис. 2 показана расстановка роботизированных портов и ассистентского порта.
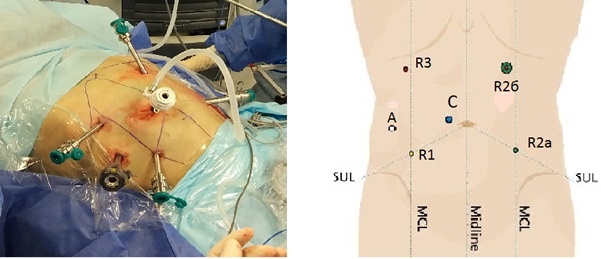
Рис. 2. Расстановка портов (схема): оптический порт-С (12 мм) расположен на 3‒4 см справа и на 3‒4 см выше пупка. Порты рук робота R1, R2, R3 (8 мм): R1 ‒ справа на пересечении линии, соединяющей пупок с передней верхней остью правой подвздошной кости, и среднеключичной линии; R2а ‒ слева на пересечении линии, соединяющей пупок с передней верхней остью левой подвздошной кости, и среднеключичной линии; R2б ‒ на 5‒6 см ниже реберной дуги и медиальнее левой среднеключичной линии на 2‒3 см; R3 ‒ на 6‒7 см ниже реберной дуги и на 2‒3 см латеральнее правой среднеключичной линии; ассистентский порт А (15 мм) ‒ на 1,5 см ниже порта-С и на 6 см латеральнее правой среднеключичной линии.
При выполнении первых 10 операций на первом этапе порты РС использовались для лапароскопических манипуляторов, мобилизации левых отделов ободочной кишки, после чего выполняли докинг и расстановку рук РС, как представлено на рис. 2. Остальные 16 операций выполнялись только роботизированно, при этом применяли методику единого докинга (singledocking), меняя позиции рук робота на различных этапах операции (выделение магистральных сосудов, мобилизация сигмовидной, нисходящей ободочной кишки и левого изгиба ободочной кишки, рука № 1 располагалась в позиции R1, рука № 2 ‒ в позиции R2б, рука № 3 – в позиции R3. Для работы в малом тазу, при выделении ПК, руку № 2 устанавливали в позицию R2а).
На первом этапе, как уже упоминалось, выполнялась «сосудистая изоляция опухоли». При этом изначально вскрывалась брюшина над правой подвздошной артерией и далее над брюшной частью аорты вплоть до проекции отхождения нижней брыжеечной артерии (НБА), не доходя 1‒1,5 см до видимой части нижней горизонтальной ветви двенадцатиперстной кишки. При правильном выполнении данного этапа, после рассечения брюшины, открывалось рыхлое межфасциальное прастранство – эмбриональный слой, отделяющий клетчатку брыжейки сигмовидной кишки от парааортальной клетчатки, а ниже мезоректальную клетчатку от пресакральной фасции. Далее мобилизация проводилась в эмбриональном слое. Данный прием имеет важное значение, так как при этом происходит так называемое фасциально-футлярное удаление клетчатки с расположенными в ней лимфатическими коллекторами единым блоком с удаляемой пораженной кишкой, что обеспечивает принципы онкологической абластики при злокачественных заболеваниях последней. После выделения основания НБА выполняется лимфаденоэктомия по ходу ее ствола до места и несколько дистальнее отхождения левой колитической артерии (a. colicasinistra). В этом месте проводилось клипирование и пересечение НБА. Таким образом, a. colicasinistra сохранялась, а клетчатка с основания НБА оставалась в препарате. Далее клипировалась и пересекалась нижняя брыжеечная вена. Данный этап операции фактически не отличается от такового в лапароскопическом варианте и проиллюстрирован на рис. 3‒6.
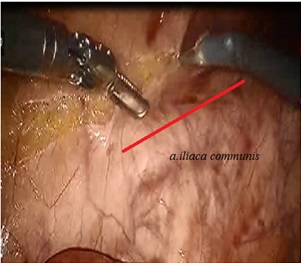
Рис. 3. Рассечение медиальной брюшины над аортой и правой подвздошной артерией.
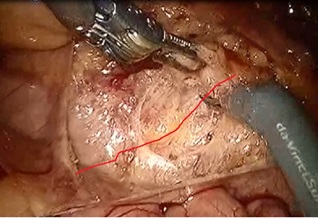
Рис. 4. Выделение нижней брыжеечной артерии (линия межфасциального пространства. Выделение в «слое»).
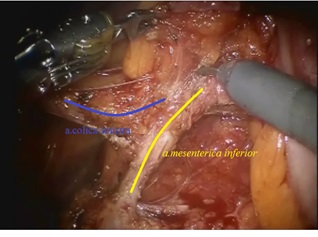
Рис. 5. Выделенный ствол нижней брыжеечной артерии от основания до места отхождения a. сolicasinistra.

Рис. 6. Клипирование (а) и пересечение (б) нижней брыжеечной артерии ниже отхождения a. colicasinistra.
Далее рассекали брюшину левого латерального канала, мобилизовали нисходящую ободочную кишку, левый изгиб ободочной кишки. После завершения мобилизации левого изгиба выполнялась перестановка 2-й руки робота из позиции R2б в позицию R2а, и далее операция продолжалась этапом мобилизации ПК. При этом вход в полость таза осуществлялся рассечением тазовой брюшины справа и мобилизацией ПК по задне- и переднеправой полуокружности. Затем мобилизация продолжалась по задней стенке и левой полуокружности, и далее по передней стенке (рис. 7‒10). В зависимости от локализации и распространения опухоли выполнялась полная или частичная мобилизация ПК с мезоректальной клетчаткой. Мобилизация ПК с окружающей жировой клетчаткой выполнялась с соблюдением принципа фасциально-футлярного удаления органа (рис. 7‒10).
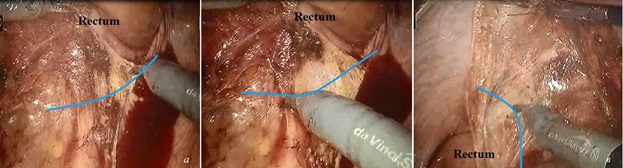
Рис. 7. Мобилизация прямой кишки и мезоректума по правой полуокружности (синей линией показано направление, по которому необходимо выполнять мобилизацию в межфасциальном пространстве): а ‒ рассечение тазовой брюшины справа; б ‒ мобилизация прямой кишки по заднеправой стенке в межфасциальном слое; в ‒ мобилизация по правой стенке.
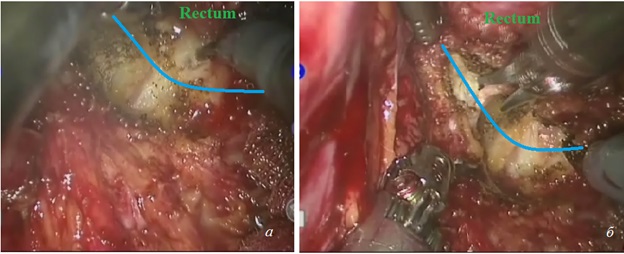
Рис. 8. Мобилизация мезоректума и прямой кишки по задней и левой полуокружности (синей линией показано направление, по которому необходимо выполнять мобилизацию в межфасциальном пространстве): а ‒ мобилизация по задней стенке; б ‒ мобилизация по левой стенке.
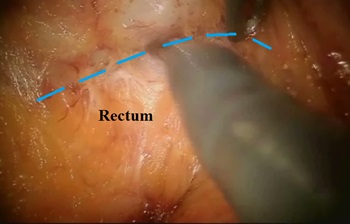
Рис. 9. Мобилизация прямой кишки и мезоректума по передней стенке.
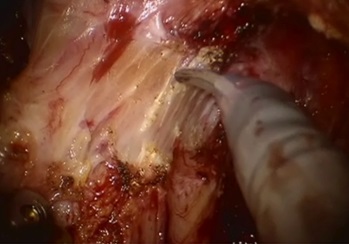
Рис. 10. Полностью мобилизованный мезоректум и прямая кишка (TMЭ).
После того как этап мобилизации ПК был завершен, ее пересечение выполнялось с использованием сшивающего аппарата Echelonflex (желтые или синие кассеты, 60 или 40 мм) или аппарата EndoGiaUniversalRoticulator (фиолетовые кассеты 45 и 60 мм) (рис. 11).
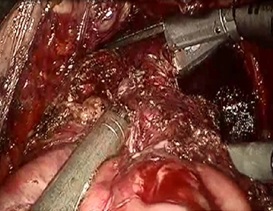
Рис. 11. Пересечение прямой кишки.
Формирование аппаратного циркулярного анастомоза выполнялось интракорпорально (рис. 12).
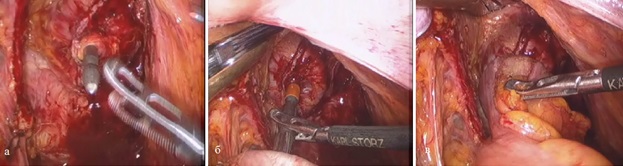
Рис. 12. Последовательное (а, б, в) формирование интракорпорального аппаратного анастомоза по типу «конец-в-конец».
Макропрепарат после роботизированной TMЭ (рис. 13).
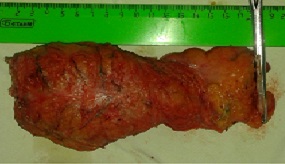
Рис. 13. Макропрепарат: прямая кишка с мезоректальной клетчаткой.
Результаты
В исследуемой группе пациентов было 10 женщин (38,5%) и 16 мужчин (61,5%). Средний возраст составил 61,56±9,3 года: женщин 59,2±10,5, мужчин 63,1±10,1. Распределение больных по стадии рака ПК было следующим: 3 пациента имели I стадию (11,5%), 8 ‒ II (30,8%), 7 ‒ III (26,9%), 5 ‒ IV (19,3%) и 3 пациента (11,5%) оперированы по поводу доброкачественных заболеваний (рис. 14).
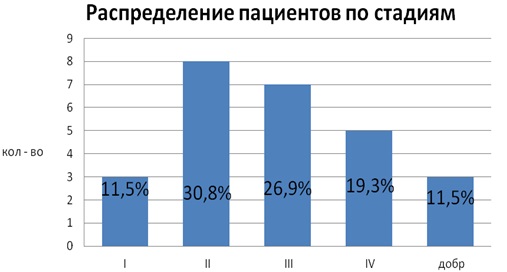
Рис. 14.Распределение пациентов по стадиям заболевания.
По местному распространению получены следующие результаты: T0 – 1 пациент (3,9%), T2 – 3 (11,5%), T3 – 14 (53,8%), T4 – 5 (19,3%) (рис. 15).
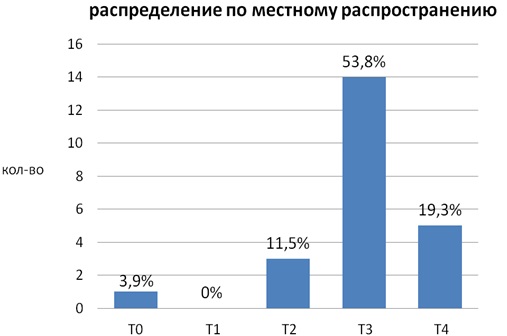
Рис. 15 . Распределение пациентов по местному распространению опухоли.
У 17 пациентов (65,4%) имелась выраженная сопутствующая патология сердечно-сосудистой системы, у 4 (15,4%) ‒ болезни органов дыхания, у 3 (11,5%) – патология эндокринных органов (табл. 1). По шкале ASA получен средний балл 2,84 (от 2 до 4), по шкале МНОАР ‒ 4,8 (от 4 до 6).
Таблица 1. Распределение пациентов по сопутствующим заболеваниям
|
Сердечно-сосудистая система, n |
Органы дыхания, n |
Эндокринная система, n |
|
17 (65,4%) |
4 (15,4%) |
3 (11,5%) |
У 19 пациентов выполнена TMЭ (73%), у 6 пациентов ‒ резекция других органов (23%), из них в 2 случаях ‒ по поводу местного распространения опухоли, в 1 случае ввиду метастатического поражения органов, в остальных случаях из-за наличия сопутствующей патологии (табл. 2).
Таблица 2. Резекция других органов
|
Мочевой пузырь, n |
Матка, n |
Яичники, n |
Печень, n |
|
1 (3,9%) |
1 (3,9%) |
3 (11,5%) |
1 (3,9%) |
Среднее время вмешательства составило 358 мин (от 670 до 210), средняя кровопотеря ‒ 203 мл (от 600 до 50). Более длительные оперативные вмешательства наблюдались при комбинированной методике вмешательства, при использовании методики Singledocking время операции в среднем составило около 320 мин (табл. 3).
Таблица 3. Длительность и кровопотеря при операциях
|
Показатель |
Гибридные операции |
Singledocking |
||||
|
Среднее значение показателя |
min |
max |
Среднее значение показателя |
min |
max |
|
|
Длительность, мин |
405 |
245 |
670 |
328 |
210 |
435 |
|
Кровопотеря, мл |
255 |
50 |
60 |
172 |
50 |
600 |
При оценке макропрепарата ни в одном случае не было зафиксировано интраоперационного повреждения целостности мезоректальной фасции при выполнении TMЭ. Среднее количество обнаруженных лимфатических узлов в макропрепарате составляло 18,5 (от 13 до 45). У 10 пациентов (38,5%) были выявлены метастазы в регионарные лимфатические узлы. В случае выполнения TMЭ аналогичные показатели составили 19,6 (от 14 до 45), при частичной ТМЭ ‒ 14,6 (от 13 до 16) (табл. 4).
Таблица 4. Число обнаруженных лимфатических узлов после роботизированных резекций прямой кишки
|
Вид резекции |
TMЭ |
Частичная ТМЭ |
||||
|
Число лимфатических узлов |
среднее |
min |
max |
среднее |
min |
max |
|
N |
19,6 |
14 |
45 |
14,6 |
13 |
16 |
При оценке боли среднее значение по ВАШ интенсивности боли составило 2,1 балла из 10 возможных. Качественная оценка по краткому опроснику боли (Вriefpaininventory) показала следующие результаты: средний балл ‒ 1,5 из 10 возможных, при этом максимальное значение 6,5 балла было зафиксировано только у 2 пациентов (табл. 5).
Таблица 5. Качественная оценка боли по опроснику Вriefpaininventory)
|
Интенсивность боли |
минимальная |
максимальная |
средняя |
|
Баллов |
0 |
6,5 |
1,5 |
При оценке влияния боли на основные повседневные процессы жизнедеятельности (повседневная активность, настроение, способность ходить, выполнять минимальную работу, сон и др.) только один пациент расценил уровень боли как значительно влияющий на повседневную активность (табл. 6, рис. 16). Длительность обезболивания составила в среднем 2,7 сут. Прибегнуть к наркотическим анальгетикам пришлось в одном случае, 9 пациентам (34,6%) введение анальгетиков в послеоперационном периоде не потребовалось.
Таблица 6. Влияние боли на повседневную активность
|
Критерий |
Влияние боли |
|
|
Среднее |
Максимальное |
|
|
Повседневная активность |
1,4 |
6 |
|
Настроение |
0,6 |
5 |
|
Способность ходить |
1,7 |
8 |
|
Способность выполнять бытовую работу |
1,8 |
10 |
|
Отношения с людьми |
0,3 |
5 |
|
Сон |
0,8 |
5 |
|
Способность получать удовольствие |
0,8 |
7 |
Рис. 16. Влияние боли на повседневную активность.
Восстановление мочеиспускания после операции наблюдалось в среднем на 2-е сутки. По шкале IPSS средний показатель составил до операции 4, через 10 дней 6,8, а через 6 мес 3 балла (табл. 7, рис. 17).
Таблица 7. Функция мочевыделения по шкале IPSS
|
Время |
До операции |
Через 10 сут после операции |
Через 6 мес после операции |
||||||
|
Значение |
среднее |
min |
max |
среднее |
min |
max |
среднее |
min |
max |
|
Результат, баллов |
4 |
0 |
18 |
6.8 |
0 |
19 |
3 |
0 |
9 |
Рис. 17. Функция мочевыделения по шкале IPSS
Важно отметить, что у 3 пациентов (11,5%) отмечена та или иная степень гипотонии мочевого пузыря, у 1 пациента (3,9%) – атония, приведшая к повторной катетеризации мочевого пузыря и формированию эпицистостомы (самостоятельное мочеиспускание восстановлено через 4 мес) (табл. 8).
Таблица 8. Урологические расстройства
|
Вид осложнения |
Недержание |
Задержка |
|
|
Гипотония мочевого пузыря |
Атония мочевого пузыря |
||
|
Количество, случаев |
0 |
3 |
1 |
|
Количество, % |
0 |
11,5 |
3,9 |
Оценка анального держания по шкале Векснера (Wexner Score) выявила следующие результаты: средний балл до операции составил 2,7 (от 0 до 7), через 10 дней после операции – 3,1 (от 1 до 8) и через 6 мес – 1,6 (от 0 до 4) (табл. 9, рис. 18).
Таблица 9. Функция анального держания по шкале Векснера
|
Время |
До операции |
Через 10 сут после операции |
Через 6 мес после операции |
||||||
|
Значение |
среднее |
min |
max |
среднее |
min |
max |
среднее |
min |
max |
|
Результат, баллов |
2,7 |
0 |
7 |
3,1 |
1 |
8 |
1,5 |
0 |
4 |
Рис. 18. Функция анального держания по шкале Векснера.
Одному пациенту (3,9%) потребовалась релапароскопия по поводу ранней спаечной кишечной непроходимости.
Длительность послеоперационного пребывания пациентов в стационаре в среднем составила 11 дней.
Вывод
Ультрапрецизионная роботизированная техника при операциях на прямой кишке за счет увеличения точности манипуляций позволяет улучшить качество мезоректумэктомии и лимфодиссекции, обеспечить сохранность элементов вегетативной нервной системы таза, снижая тем самым количество расстройств тазовых органов в послеоперационном периоде.
Литература
1. Lange M.M., Rutten H.J., van de Velde C.J. One hundred years of curative surgery for rectal cancer: 1908(2008). Europ. J. Surg. Oncol. 2009;35(5):456-463.
2. Havenga K., De Ruiter M.C., Enker W.E., Welvaart K. Anatomical basis of autonomic nerve-preserving total mesorectal excision for rectal cancer. Br J Surg, 1996;83:384-388.
3. Heald R.J., Chir M., SmedhR.K. Abdominoperineal excision of the rectum – an endangered operation. Dis. Col. Rectum. 1997;40(7):747-751.
4. Heald R.J., Husband E.M., Ryall R.D. The mesorectum in rectal cancer surgery—the clue to pelvic recurrence? Brit. J. Surg. 1982;69(10):613-616.
5. Enker W.E., Thaler H.T., Cranor M.L., Polyak T. Total mesorectal excision in the operative treatment of carcinoma of the rectum. J Am CollSurg, 1995;181:335-346.
6. Атрощенко А.О. и др.[ВК12] История развития лапароскопической хирургии. Онкологическая колопроктология. 2012;2:35-39.
7. Атрощенко А.О. и др Основные этапы развития лапароскопической хирургии в онкологической колопроктологии. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2012;23:3-9.
8. Атрощенко А.О. и др. Лапароскопические циторедуктивные операции при диссеминированном раке ободочной кишки. Доктор. Ру. 2014;3(91):90-94.
9. Атрощенко А.О. и др. История развития роботизированной хирургии и ее место в современной колопроктологии: обзор литературы. Злокачественные опухоли. 2014;1:3-14.
10. Ballantyne G.H., Merola P., Weber A. Wasielewski A. Robotic solutions to the pit falls of laparoscopic colectomy. OspItalChir, 2001;7:405-412.
11. Jones S.B., Jones D.B. Surgical aspects and future developments in laparoscopy. Anesthiol. Clin. North Am. 2001;19:107-124.
12. Kim V.B., Chapman W.H., Albrecht R.J. et al. Early experience with telemanipulative robot-assisted laparoscopic cholecystectomy using Da Vinci. Surg. Laparosc. Endosc. Percutan. Tech. 2002:12:34-40.
Satava R.M., Bowersox J.C., Mack M. et al. Robotic surgery: state of the art and future trends. ContempSurg, 2001;5